在日常生活中,人們需要透過各種生理性重複刻板行為(例如洗手和刷牙)來滿足正常的生活需求。在自閉症和強迫症等精神疾病中,患者常常表現出一系列病理性重複刻板行為。病理性重複刻板行為被認為是窺探這些精神疾病發病機理的視窗,受到眾多研究者的關注。當研究者在小鼠的基因組中引入人類自閉症和強迫症的基因突變後,驚奇地發現“患病”小鼠竟然也出現了病理性重複刻板行為,表現為長時間的重複刻板的自我梳理(self-grooming)【1-4】。自我梳理(self-grooming)是人和動物清除自身體表異物(例如汙垢)的本能行為,具有重要的生物學意義。針對這類本能行為的神經機制的研究,有望揭示重複刻板行為發生的底層邏輯。已有的研究多集中於前腦區域,包括“皮層-紋狀體”環路對自我梳理行為的調控功能【5-7】。然而,大腦與脊髓之間如何協同並引發重複刻板行為的神經機制還很不清楚。
2021年12月20日,北京生命科學研究所的曹鵬實驗室在Neuron上線上發表了題為A brain-to-spinal sensorimotor loop for repetitive self-grooming的研究論文。該研究發現,在三叉神經脊髓核的尾側部(caudal part of the spinal trigeminal nucleus,Sp5C),表達小腦素-2 (Cerebellin-2, Cbln2)的神經元形成一條向脊髓投射的下行神經通路,在維持自我梳理的重複刻板行為中扮演了重要的角色。Cbln2+ Sp5C神經元的失活阻斷了感覺誘發和壓力誘發的重複性自我梳理行為。這些神經元的啟用則觸發了類似自我梳理行為的重複前肢運動。研究者進一步證明,Cbln2+ Sp5C神經元接受來自三叉神經節感覺神經元和下丘腦室旁核神經元的輸入。Cbln2+ Sp5C神經元形成一條向脊髓投射的下行通路,支配脊髓頸段的運動神經元和中間神經元,是自我梳理重複刻板行為的充分且必要條件。這些研究結果表明,腦與脊髓的協同在重複刻板行為中扮演了重要角色。作者最後提出了一個有趣的閉環神經機制模型:每次自我梳理將再次啟用小鼠的Cbln2+ Sp5C神經元,並進一步促進下一個週期的自我梳理行為,形成了一個反饋式的閉環神經機制來維持重複刻板行為的發生。
1. 建立三種誘發自我梳理的行為正規化和測量重複性自我梳理行為的定量分析方法
首先,研究者使用三種不同的外部刺激誘導重複性自我梳理行為,分別對應:面部滴加玉米油——感覺刺激,面部皮下注射辣椒素——化學刺激,足底電擊——壓力應激刺激。三種刺激方法均能引起小鼠針對面部的重複性自我梳理行為。為了對這些行為進行定量分析,研究者在小鼠前肢包埋微型磁鐵,並將其置於電磁場中,產生的電磁訊號能夠跟蹤重複的前肢體運動,進而代表重複的自我梳理行為。
然後,研究者使用不同體積的玉米油誘導小鼠面部自我梳理,發現該行為的持續時間依賴於玉米油的體積。研究者進一步透過對TrkB-CreER、TH-2A-CreER、Mrgprb4-TdTomato-2A-Cre小鼠的三叉神經節(trigeminal ganglion, TG)雙側注射AAV-DIO-EGFP-2A-TeNT載體失活特定型別神經元,發現三叉神經節中負責感受觸覺刺激的 TrkB+ 神經元失活能顯著降低玉米油誘導的自我梳理行為的持續時間,說明三叉神經節中負責觸覺的TrkB+ 神經元參與了玉米油誘導的重複性自我梳理行為。
2. Cbln2+ Sp5C神經元是面部自我梳理行為的關鍵神經元亞型
接下來,研究者深入分析自我梳理行為的中樞機制。三叉神經節中的感覺神經元向腦內三叉神經複合體投射。三叉神經複合體包括了三叉神經主核(principal trigeminal nucleus, Pr5)和三叉神經脊髓核(spinal trigeminal nucleus, Sp5)。其中三叉神經脊髓核的尾側部(caudal part of the spinal trigeminal nucleus,Sp5C)因其與脊髓背角(spinal dorsal horn)的結構相似,又被稱為延髓背角(medullary dorsal horn)。在脊髓背角的研究領域中,已知表達Cbln2, PV, CCK和NPY的神經元負責加工機械刺激的資訊。因此研究者透過對Cbln2-IRES-Cre,PV-IRES-Cre,CCK-IRES-Cre和NPY-IRES-Cre小鼠的Sp5C注射AAV-DIO-hM4Di-mCherry病毒,腹腔注射CNO,對特定神經元進行化學遺傳學抑制。他們發現,Cbln2+ Sp5C神經元被抑制時,能夠使玉米油、辣椒素、壓力應激誘導的面部自我梳理行為的持續時間下降,而化學抑制其他神經元亞型(PV+, CCK+, NPY+)造成的影響不顯著。這暗示Cbln2+ Sp5C神經元可能是調控這一行為的神經環路中的重要組成部分。
3. Cbln2+ Sp5C神經元的啟用可以引發類似自我梳理的前肢運動
接下來,研究者對Cbln2-IRES-Cre小鼠的Sp5C注射AAV-DIO-ChR2-2A-mCherry病毒幷包埋光纖。他們發現,光啟用Cbln2+ Sp5C神經元能夠引發小鼠類似面部自我梳理的重複性前肢運動。經過定量分析,發現這一運動的頻率依賴於鐳射的強度和頻率。研究者進一步發現,化學遺傳學啟用Cbln2+ Sp5C神經元也可以引起小鼠重複刻板的面部自我梳理行為,使用抗抑鬱藥物弗西汀(fluoxetine)可以減少這一行為的持續時間。
4. Cbln2+ Sp5C神經元的形態和生理特性
研究者透過對Cbln2-IRES-Cre小鼠的Sp5C注射AAV-DIO-hM3Dq-mCherry載體,觀察其與不同型別神經元的標誌性基因mRNA(如Vglut2和Vgat)的共定位,發現Cbln2+ Sp5C神經元主要為穀氨酸能神經元。研究者還在Cbln2-IRES-Cre小鼠的Sp5C表達GCaMP7並進行光纖記錄,發現在玉米油誘導產生面部自我梳理行為時,神經元的鈣訊號隨之震盪。透過進一步分析後,研究者發現鈣訊號滯後於自我梳理行為,因此推測Cbln2+ Sp5C神經元並非啟動這一行為,而可能是參與了這一行為的維持。除此之外,研究者還對小鼠身體的其他部位進行測試滴加玉米油,並且利用Von Frey纖維絲對小鼠身體的同側和對側進行機械測試,發現Cbln2+ Sp5C神經元偏好對身體同側面部的刺激。
5. Cbln2+ Sp5C神經元的輸入和輸出
透過狂犬病毒示蹤的方法,研究者發現Cbln2+ Sp5C神經元接受來自三叉神經節內LTMRs和TRPV1+ 感覺神經元的輸入,同時還接受來自初級體感皮層(S1)、下丘腦室旁核(PVH)等腦區的輸入。透過在Cbln2-IRES-Cre小鼠的Sp5C表達Cre依賴的EGFP進行順向追蹤,研究者發現這些神經元向丘腦腹後內側核(VPM)、外側臂旁核(LPB)以及脊髓腹角(ventral horn)投射。進一步的實驗表明,投射到LPB與脊髓的Cbln2+ Sp5C神經元在Sp5C中被明顯地分隔成為兩群。這些資料暗示,Cbln2+ Sp5C神經元形成了一條通向脊髓頸段,用於調控前肢運動的獨特下行通路。
6. 投射到脊髓的Cbln2+ Sp5C神經元在面部自我梳理中的關鍵作用
透過在Cbln2-IRES-Cre小鼠的Sp5C注射AAV-fDIO-hM3Dq-mCherry,在脊髓注射AAV2-retro-DIO-Flp,腹腔注射CNO,研究者發現特異性化學遺傳啟用Sp5C向脊髓投射的Cbln2+神經元能夠引起小鼠重複性面部自我梳理行為。
另一方面,對向脊髓投射的Cbln2+ Sp5C神經元進行化學遺傳學抑制,能夠顯著降低玉米油、辣椒素和足底電擊引起的小鼠面部自我梳理行為的持續時間。這些資料表明,向脊髓投射的Cbln2+ Sp5C神經元可能在小鼠面部自我梳理的重複刻板行為中起到關鍵作用。
7. 脊髓投射Cbln2+ Sp5C神經元的特徵分析
最後,研究者透過狂犬病毒示蹤的方法追蹤向脊髓投射的Cbln2+ Sp5C神經元的上游。他們發現這些神經元可能整合了來自TG的TrkB+ 神經元、TRPV1+ 神經元、以及來自PVH 神經元的輸入。
除此之外,他們還對向脊髓投射的Cbln2+ Sp5C神經元進行了面部自我梳理行為的光纖記錄,觀察到了鈣訊號的顯著上升,同時這些神經元對同側面部的機械刺激也表現出明顯的鈣訊號反應。這些資料表明,向脊髓投射的Cbln2+ Sp5C神經元編碼了同側面部的機械刺激。
8. 結論與“感覺-運動閉環”模型的提出
綜上所述,這一研究發現Cbln2+ Sp5C神經元向脊髓頸段的投射通路對小鼠面部自我梳理的重複刻板行為至關重要。研究得到了三個主要結論。第一,研究揭示了延髓背角的Cbln2+ Sp5C神經元作為一個獨特的神經元亞型可以調控面部自我梳理的本能重複刻板行為。這一神經元亞型與表達其它標記分子的典型神經元亞型(PV+、NPY+和CCK+)不同。第二,Cbln2+ Sp5C神經元的脊髓投射的發現可能為腦-脊髓協調產生重複刻板行為提供重要的線索。第三,研究者的資料可能為強迫症和圖雷特綜合症小鼠模型提供了新的理解。研究者發現表達Cbln2的Sp5C神經元的啟用引發了面部自我梳理的重複刻板行為對氟西汀的治療敏感,暗示Cbln2+ Sp5C神經元可能參與了強迫症小鼠模型中過度自梳行為的產生。
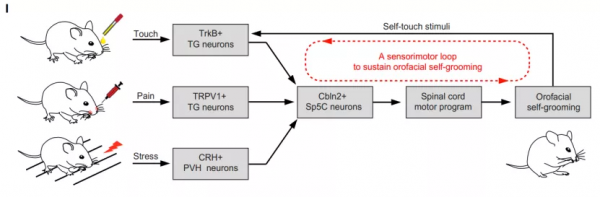
基於以上結論,研究者提出一個關於重複刻板行為的“感覺-運動閉環”模型:小鼠每次自我梳理將啟用Cbln2+ Sp5C神經元,進一步促進了下一週期的自我梳理行為,因此形成了一個反饋式的閉環神經機制來維持重複刻板行為的發生。
圖 “感覺-運動閉環”模型的提出 圖片引自:Xie et al., Neuron 2021
北京生命科學研究所曹鵬實驗室的謝志勇、李大鵬、程欣宇、裴青和谷華婷是研究論文的共同第一作者。實驗室其他成員(陶婷、黃美珠、尚從平、耿丹丹、趙淼、劉愛學)也對該研究做出了重要貢獻。中國醫學科學院的馬原武博士、河北醫科大學的張凡博士和首都醫科大學的張晨博士是主要合作者,為此項研究做出了重要貢獻。
原文連結:
https://doi.org/10.1016/j.neuron.2021.11.028
參考文獻
[1] Welch, J.M., Lu, J., Rodriguiz, R.M., Trotta, N.C., Peca, J., Ding, J.D., Feliciano, C., Chen, M., Adams, J.P., Luo, J., et al. (2007). Cortico-striatal synaptic defects and OCD-like behaviours in Sapap3-mutant mice. Nature 448, 894–900
[2] Shmelkov, S.V., Hormigo, A., Jing, D., Proenca, C.C., Bath, K.G., Milde, T., Shmelkov, E., Kushner, J.S., Baljevic, M., Dincheva, I., et al. (2010). Slitrk5 deficiency impairs corticostriatal circuitry and leads to obsessive-compulsive-like behaviors in mice. Nat. Med. 16, 598–602.
[3] Peca, J., Feliciano, C., Ting, J.T., Wang, W., Wells, M.F., Venkatraman, T.N., Lascola, C.D., Fu, Z., and Feng, G. (2011). Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature 472, 437-442.
[4] Schmeisser, M.J., Ey, E., Wegener, S., Bockmann, J., Stempel, A.V., Kuebler, A., Janssen, A.L., Udvardi, P.T., Shiban, E., Spilker, C., et al. (2012). Autistic-like behaviours and hyperactivity in mice lacking ProSAP1/Shank2. Nature 486, 256-260.
[5] Ahmari, S.E., Spellman, T., Douglass, N.L., Kheirbek, M.A., Simpson, H.B., Deisseroth, K., Gordon, J.A., and Hen, R. (2013). Repeated cortico-striatal stimulation generates persistent OCD-like behavior. Science 340, 1234–1239.
[6] Burguiere, E., Monteiro, P., Feng, G., and Graybiel, A.M. (2013). Optogenetic stimulation of lateral orbitofronto-striatal pathway suppresses compulsive behaviors. Science 340, 1243–1246.
[7] Yu, X., Taylor, A.M.W., Nagai, J., Golshani, P., Evans, C.J., Coppola, G., and Khakh, B.S. (2018). Reducing Astrocyte Calcium Signaling In Vivo Alters Striatal Microcircuits and Causes Repetitive Behavior. Neuron 99, 1170– 1187.e9.