12月22日,諾華宣佈,美國FDA批准其同類首創(first-in-class)小干擾RNA(siRNA)藥物Leqvio (Inclisiran)上市,每年只需注射兩次,用於治療接受最高耐受劑量他汀療法後,仍存在高水平低密度脂蛋白膽固醇(LDL-C)的成人患者。
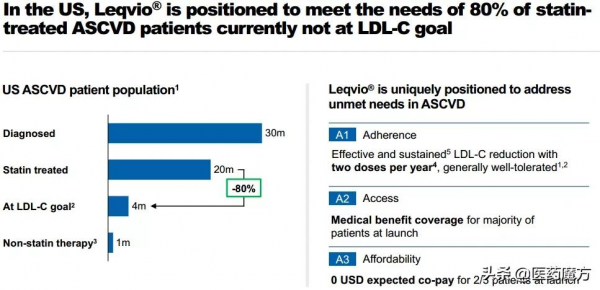
Leqvio是FDA批准的首款也是唯一一款用於降低LDL-C的siRNA藥物,有望為美國80%他汀類藥物治療後LDL-C仍不達標ASCVD患者帶來新的治療選擇。
在全球,心血管疾病是威脅人類健康的“第一殺手”,位居全球死因首位。高血脂是導致動脈粥樣硬化性心血管疾病(ASCVD)的主要危險因素之一。長期持續暴露於高水平的LDL-C會使ASCVD風險增高,或可導致心梗、卒中等心血管事件的發生。50年的證據表明,有效且持續的LDL-C降低可改善心血管結局,LDL-C每降低1mmol/L,3年後ASCVD事件相對風險降低20%,隨後每年降低1.5%。
目前,全球有超過1.35億ASCVD患者,只有20%左右達到指南推薦的LDL-C控制目標水平。 現有他汀類療法雖然在降低LDL-C方面效果顯著,但他汀類藥物在高劑量時會提高PCSK9蛋白的表達水平,一定程度上限制了它降低LDL-C水平的程度。抑制PCSK9的生物合成,能夠更有效地降低血液中的LDL-C水平。
Inclisiran是一款first-in-class siRNA藥物,能夠與RNA誘導沉默複合體(RISC)結合,並在反義鏈的介導下與編碼PCSK9蛋白的mRNA結合,抑制PCSK9蛋白的產生。從而阻止PCSK9介導的與低密度脂蛋白受體(LDLR)降解,使得能夠清除血液中低密度脂蛋白的LDLR的數量增加,從而降低LDL-C水平。
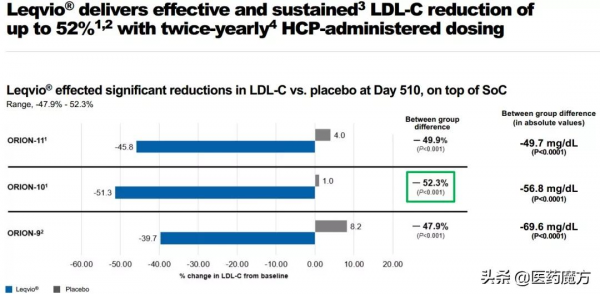
Inclisiran此次批准是基於關鍵III期、安慰劑對照、雙盲ORION(ORION-9、-10和-11)臨床研究資料。研究結果顯示,對於使用最大耐受劑量他汀類藥物治療後仍無法使LDL-C達標的患者,Inclisiran可以達到52%的LDL-C下降。此外,Inclisiran在首次及第3個月初始治療後,每年只需注射兩次的給藥方案,有望解決患者長期依從性困境。
今年9月諾華公佈了ORION-9、-10和-11臨床試驗的兩項彙總事後分析結果。研究表明,每年接受兩次Inclisiran治療,可以有效且持續地降低ASCVD兩個亞組患者的LDL-C水平。這兩個亞群分別為伴隨腦血管疾病(CeVD)和多血管疾病 (PVD)的ASCVD患者。相關分析結果已在2021年歐洲心臟病學會年會(ESC)上公佈。
安全性方面,在III期試驗中,Inclisiran的耐受性良好。報告的最常見不良事件包括:注射部位反應、關節痛、尿路感染、腹瀉、支氣管炎、四肢疼痛和呼吸困難。其中,注射部位反應最為常見。這些不良反應通常是輕微的,無嚴重或持續性不良事件發生。
Inclisiran已於2020年12月率先在歐盟獲批上市,截止目前已在全球50個國家獲批。今年7月,Inclisiran首次登陸中國博鰲樂城,率先在海南博鰲樂城先行區完成首批患者注射。
諾華正在開展多項研究,以使Inclisiran成為ASCVD管理的標準護理方法。Inclisiran還將被開發用於治療純合子家族性高膽固醇血癥 (HoFH)、心血管疾病患者的一級或二級預防。
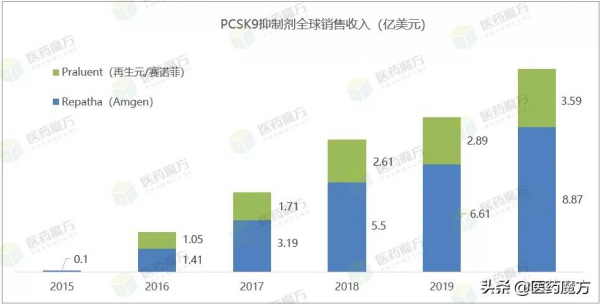
此前,全球已有兩款靶向PCSK9的藥物獲FDA批准上市,分別為賽諾菲/再生元的Praluent(阿利西尤單抗)和安進的Repatha(依洛尤單抗),前者於2015年在美國獲批上市,是FDA批准的首個PCSK9抑制劑。對於Praluent,患者需要每兩週注射1次。對於Repatha,患者需要每月注射1次。這不僅對患者依從性帶來了挑戰,也增加了患者的經濟負擔。根據各家公司財報披露,目前安進的Repatha佔據較高的市場份額,達到71.1%。
諾華的Leqvio在美國的批准時間曾被暫時延遲,但是這款每6個月注射1次的siRNA療法是降脂領域的重大突破,在生產成本和價格競爭上更有優勢,市場表現值得期待。