撰文 | YQ
責編 | 翊竑
糖尿病是一種以血糖慢性升高為特徵的慢性代謝性 疾病,其併發症可以導致失明、截肢、腎衰等疾病,嚴重威脅人類健康。糖尿病分為兩種型別,其中1型糖尿病的主要發病機制是由於各種原因導致的胰島β細胞數量減少或者功能損傷,繼而引起胰島素的分泌不足,導致糖尿病的發生。因此,促進β細胞複製增殖、誘導非胰島β細胞直接分化產生新的β細胞是潛在的改善糖尿病的有效方法之一。
人體的腸道發揮著消化和吸收營養物質的重要功能,同時也是一種內分泌器官。腸道里面分布著多種腸內分泌細胞(Intestinal Enteroendocrine Cell),可以透過分泌多種神經內分泌肽調節食慾、代謝、腸蠕動等多種重要的生理過程。腸內分泌細胞被證實與胰島β細胞表達很多相同的基因,包括一些激素(如:somatostatin 和 ghrelin)以及一些關鍵的轉錄因子。已有研究表明,當抑制一些關鍵的轉錄因子活性後,部分腸內分泌細胞可以表達胰島素基因。因此,在胎兒還未發育成熟的腸道中,可能存在一些可以分泌胰島素的腸內分泌細胞。
近日,來自Weizmann Institute of Science的Shalev Itzkovitz課題組與耶魯大學的Liza Konnikova課題組合作,在Nature Medicine上發表了題為Insulin is expressed by enteroendocrine cells during human fetal development的文章,透過單細胞測序的方法,發現了胚胎髮育期的腸內分泌細胞中存在一群能夠表達胰島素基因的細胞。
作者採集4例胚胎髮育期的小腸樣本,其中兩例來自胎齡21周,兩例來自胎齡23周;另外2例為新生兒的小腸樣本,其中一例新生兒出生2天,另一例2週年齡,作者對這6例樣本,應用10x Genomics單細胞mRNA測序的方法,進行了單細胞mRNA測序。經過質控,作者獲得了36,359個高質量的細胞,作者將這些細胞分成了11亞群,分別為:1.腸上皮細胞, 2. 腸內分泌細胞, 3. 成纖維細胞, 4. 內皮細胞, 5.淋巴管內皮細胞, 6. 神經元, 7. B細胞, 8. T/ NK細胞, 9. dividing T/NK細胞, 10.巨噬細胞, 11.樹突細胞。作者對這些細胞做了差異基因分析,發現有一群來源於胚胎髮育期的腸內分泌細胞高表達INS(編碼胰島素蛋白)基因。為了進一步探索表達INS基因的細胞,作者將腸內分泌細胞進一步分成了5群,發現表達INS基因的細胞主要集中在胚胎期的K/L 這一群細胞中,作者將表達表達INS基因的胚胎期K/L細胞命名為INS + K/L (FIKL) cells。進一步的分析顯示,這一群細胞與胚胎期的胰島細胞的的基因表達譜較為相近,FIKL細胞中,最顯著的高表達基因為RGS16,該基因編碼的蛋白能夠促進胰島素的分泌。
圖1. 單細胞測序顯示腸內分泌細胞中存在一群高表達INS基因的細胞
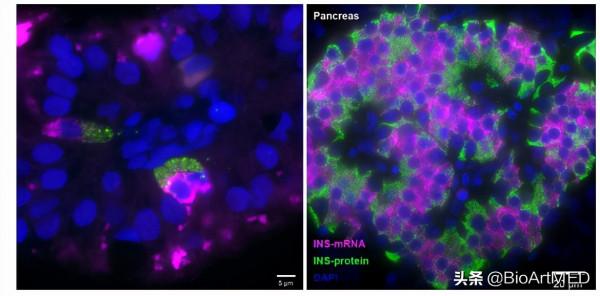
作者進一步分析了8-12周的胚胎期腸細胞的單細胞測序資料,發現在該階段也有一些腸內分泌細胞表達INS基因 ,這群細胞仍然存在於fetal K/L這一群細胞中。為了進一步證明,在腸內分泌細胞中確實存在一群可以表達INS基因的細胞,作者應用了單分子熒光原位雜交 (smFISH) 以及免疫熒光的方法檢測了胚胎期腸組織中細胞內的胰島素mRNA以及胰島素蛋白的表達情況。作者發現,與單細胞測序結果一致,胰島素mRNA只在胚胎期的腸組織中能夠被檢測到,在新生兒的腸組織中無法檢測到胰島素mRNA的表達。胰島素免疫熒光的實驗進一步證實了該結果,說明了高表達胰島素基因的腸內分泌細胞確實存在於胚胎期的小腸組織中。
圖2. 腸內分泌細胞表達胰島素基因
綜上,作者透過單細胞測序的方式證實了在胚胎髮育期的腸內分泌細胞中確實存在一群可以表達胰島素基因的細胞。這篇文章以brief communications的形式發表在Nature Medicine,正如作者在討論中提到,該研究並未闡明表達胰島素基因的調控機制及其作用。但是這一發現為1型糖尿病的治療提供了新的方向,提示了後續的致力於研究新生兒的小腸內分泌細胞不再表達胰島素基因的調控機制,或許能夠找到讓成年個體的腸內分泌細胞重新表達胰島素基因的方法,對於1型糖尿病治療方法的開發具有重要的作用。
原文連結:
https://www.nature.com/articles/s41591-021-01586-1
製版人:十一
轉載須知
【原創文章】BioArtMED原創文章,歡迎個人轉發分享,未經允許禁止轉載,所刊登的所有作品的著作權均為BioArtMED所擁有。BioArtMED保留所有法定權利,違者必究。