時光荏苒如白駒過隙,往事依稀若素月流空。又到歲末,雖然新冠疫情仍是全球主要關注的醫療事件,但也未能阻擋醫學進步。回望2021年,我們迎來了一些重磅臨床研究的關鍵結果,其中不乏可能重塑醫學的全新突破。今天,醫藥魔方Med團隊摘選出2021年披露的具有“重大里程碑”意義的臨床研究結果,為大家做一分享。
NO.1 阿替利珠單抗輔助治療NSCLC的III期IMpower010研究
公司:羅氏
臨床意義:肺癌領域首個免疫輔助療法
2021年3月22日,羅氏公佈了阿替利珠單抗輔助治療II-IIIA期非小細胞肺癌的關鍵III期研究(IMpower010)的中期分析資料。
IMpower010是一項全球、多中心、隨機、開放標籤的臨床III期研究,旨在評估阿替利珠單抗與最佳支援療法(BSC)的療效和安全性。該研究共入組了1,005例患者,以1:1隨機接受最多16個週期的Tecentriq或BSC。主要終點是無疾病生存期(DFS),關鍵次要終點包括OS等。結果顯示,阿替利珠單抗相比BSC顯著改善DFS,試驗達到主要終點。
IMpower010研究關鍵結果(來源:ESMO2021)
IMpower010研究是首個在早期肺癌輔助免疫治療中獲得陽性結果的III期臨床研究。在PD-L1 TC ≥1%的II-IIIA期人群中,阿替利珠單抗輔助治療可降低34%的疾病復發或死亡風險(HR,0.66 95%Cl:0.50,0.88)。基於此,FDA於2021年10月批准了阿替利珠單抗的新適應症,用於完全切除的IIB-IIIA期或高風險IIA期、PD-L1≥1%且既往接受輔助化療的NSCLC患者。10月29日,NCCN非小細胞肺癌2021年第7版指南就對此進行了更新。
除此之外,輔助免疫治療也已經全面進入更多的疾病領域。納武利尤單抗新輔助治療可切除Ib-IIIa期非小細胞肺癌也顯著改善 pCR,已經獲批輔助治療尿路上皮癌、黑色素瘤和食管癌或胃食管交界腺癌;帕博利珠單抗聯合化療也被批准用於三陰性乳腺癌(TNBC)的新輔助和單藥輔助治療,以及IIB、IIC期和III期黑色素瘤的輔助治療,並在腎細胞癌輔助治療研究中達到主要終點。
NO.2 蘆可替尼治療白癜風的III期TruE-V研究
公司:Incyte
臨床意義:白癜風有望迎來首個靶向療法
2021年5月17日,Incyte宣佈了蘆可替尼治療白癜風的關鍵III期 TruE-V 臨床試驗關鍵資料。TruE-V包括兩項III期研究,TRuE-V1(NCT04052425)和TRuE-V2(NCT04057573),旨在評估蘆可替尼乳膏對白癜風患者的安全性和有效性。資料顯示,兩項研究均達到了主要終點,表明蘆可替尼乳膏治療組與對照組相比,更多患者的第24周面部白斑面積評分指數 (F-VASI75) 相比基線改善≥75%。
白癜風是一種慢性自身免疫性疾病,其特徵是面板色素脫失,這是由產生色素的細胞(稱為黑素細胞)的喪失造成的。既往研究顯示,JAK訊號通路的過度活動與白斑病發病機制和繼發炎症相關。白癜風影響了全球大約 0.5%-2.0%的人口,目前尚無被美國食品藥品監督管理局 (FDA) 或歐洲藥品管理局 (EMA) 批准的靶向藥物。
此外,Jak抑制劑巴瑞替尼是第一個在斑禿III期臨床試驗(BRAVE-AA2)中取得陽性結果的靶向藥物,巴瑞替尼也有望成為第一個治療斑禿的靶向藥物。
NO.3 Nivolumab+relatlimab治療黑素瘤的II/III期RELATIVITY-047研究
公司:百時美施貴寶(BMS)
臨床意義:首個披露III期臨床積極結果的靶向LAG-3抗體,黑素瘤迎來新型IO療法
2021年5月19日,BMS公佈了relatlimab和nivolumab組合療法一線治療轉移性或不可切除黑素瘤的II/III期試驗RELATIVITY-047(NCT03470922)資料。這是一項全球性、隨機、雙盲的II/III期研究,在先前未接受治療的轉移性或不可切除的黑色素瘤患者中評估了relatlimab 和 nivolumab 固定劑量對比Opdivo單藥的療效。
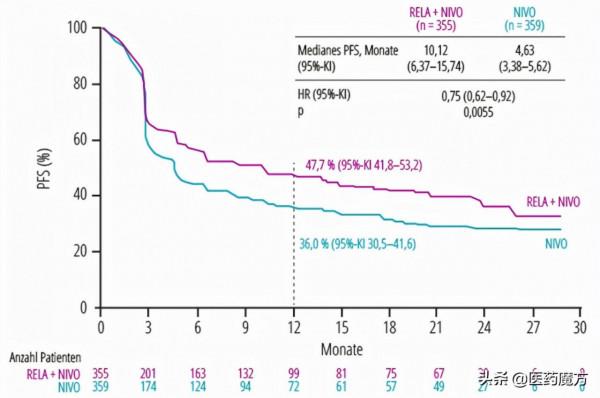
714名患者被隨機分組,每四周靜脈滴注一次固定劑量的relatlimab(160 mg)和nivolumab(480mg)或nivolumab(480mg),直至疾病復發、出現不可接受的毒性。研究結果顯示,nivolumab+relatlimab vs. nivolumab 的mPFS為10.12 vs 4.63 月。安全性可控,與之前報道的情況一致,兩組的 3/4級藥物相關不良事件發生率為18.9% vs 9.7%,因藥物不良事件導致停藥的患者比例為 14.6% vs6.7%。
RELATIVITY-047研究關鍵結果
PD-1/L1成功之後,業界一直在尋找下一個免疫療法。Relatlimab是一種LAG3抗體,也是少數III期臨床成功的新型IO藥物,在勢頭上超過TIGIT療法。不過,羅氏在12月召開的ESMO-IO大會上也口頭報告了II期CITYSCAPE研究的最新隨訪結果,TIGIT抗體tiragolumab+阿替利珠單抗 vs 阿替利珠單抗一線治療PD-L1陽性轉移性NSCLC持續顯示有益的臨床獲益(ORR改善),使ITT人群的疾病進展或死亡風險降低了38%。
NO.4 NTLA-2001治療TTR澱粉樣變性的I期研究
公司:Intellia和 Regeneron
臨床意義:首個披露人體陽性資料的基因編輯藥物
2021年6月26日,Intellia和Regeneron聯合宣佈體內CRISPR-Cas9基因組編輯療法 NTLA-2001治療轉甲狀腺素蛋白澱粉樣變 (ATTR)的I期臨床研究獲得積極中期資料。結果顯示,第28天,0.1 mg/kg劑量組血清TTR蛋白水平較基線平均降低了52%,而0.3 mg/kg劑量組,血清TTR蛋白水平降低了 87%。這是首個支援人體體內CRISPR基因組編輯的安全性和有效性臨床試驗資料。
NTLA-2001是第一個透過靜脈系統給藥的CRISPR/Cas9基因編輯療法,透過奈米脂質體顆粒包裹TTR sgRNA與編碼Spy Cas9蛋白的mRNA分子,向肝臟細胞遞送CRISPR基因編輯系統,從而在體內完成對突變型TTR基因的敲除,以降低體內錯誤摺疊的TTR蛋白水平。
兩個劑量組納入中期分析的6例患者對NTLA-2001耐受性普遍良好,至28天未出現嚴重不良事件,實驗室檢查未見肝臟或凝血功能異常。鑑於目前為止觀察到的安全性和耐受性,NTLA-2001 的劑量遞增研究正在進行中,以確定更高劑量能否使致病蛋白水平進一步降低,從而可能產生更有意義的臨床效益,預計2022年會有完整的結果。
NO.5 Enhertu治療HER2陽性轉移性乳腺癌的III期DESTINY-Breast03研究
公司:第一三共/阿斯利康
臨床意義:首個Her2ADC頭對頭研究,有望改變治療格局
2021年9月,Enhertu(trastuzumab deruxtecan,T-Dxd)對比T-DM1二線治療HER2陽性晚期乳腺癌的頭對頭全球多中心Ⅲ期Destiny-Breast03研究資料在歐洲腫瘤內科學會(ESMO)年會上公佈。
T-DXd是一種靶向HER2的ADC,基於DESTINY-Breast01 (NCT03248492)研究結果,被批准用於HER2陽性晚期乳腺癌3線及以上患者治療。DESTINY-Breast03 (NCT03529110)是一項多中心、開放標籤、隨機III期研究,在既往接受過曲妥珠單抗和紫杉醇治療的患者中比較T-DXd與T-DM1在HER2陽性晚期乳腺癌患者中的療效和安全性。作為首個頭對頭對比ADC藥物二線治療HER2陽性晚期乳腺癌的Ⅲ期研究,DESTINY-Breast03備受關注。524例患者隨機接受T-DXd或T-DM1,雖然最終資料尚未成熟,但T-DXd在頭對頭研究中勝出已經毫無懸念。
主要終點方面,T-DXd經盲法獨立中心評估 (BICR)顯著降低疾病進展達82%,研究者評估的mPFS為25.1月(T-DM1為7.2月)。關鍵次要終點方面,T-DXd也顯著延長患者中位總生存期,降低死亡風險44%。
T-DXd在DESTINY-Breast03研究中的勝出,重新定位了HER2陽性晚期乳腺癌二線治療的mPFS、mOS數值新高度,也是繼恩美曲妥珠單抗上市以來,首個在頭對頭研究中顯示優勢的Her2-ADC療法,或將在不久的未來影響HER2+mBC治療正規化的轉變。
更重要的是,T-DXd無論在HER2高表達、低表達還是無表達患者中,均能顯示治療益處。在晚期乳腺癌DAISY研究中,T-Dxd治療HER2高表達組應答率為69%(47/68)、低表達組為33%(24/72)、無表達組為31%(11/36),mPFS三組分別為11.1、6.7和4.2個月。
NO.6 Luminopia One治療兒童弱視的III期研究
公司:Luminopia
臨床意義:十多年來首個取得成功的新型弱視治療隨機對照試驗
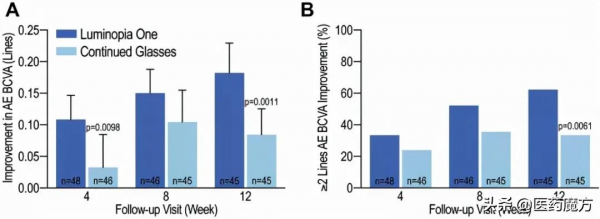
2021年9月14日,Luminopia在美國眼科學會期刊Ophthalmology上公佈其弱視研究性治療方法Luminopia One的臨床III期關鍵資料。該項研究共入組了105例4至7歲弱視兒童患者。受試者按1:1隨機分組,分別接受Luminopia One和戴鏡治療(n=51),或僅接受戴鏡治療(n=54)。結果顯示,依照標準對數視力表(logMAR),第12周時,治療組患者的弱眼視力在logMAR視力表上平均提高1.8行,而對照組僅提高0.8行。組間視力改善具有顯著性差異(p=0.001)。該研究因達到主要終點而提前停止,未報告嚴重不良事件。
此外,12周隨訪中,治療組視力改善2行及以上患者達62%,對照組僅33%。值得注意的是,治療組中84%的患者曾接受眼罩或阿托品治療仍存在弱視,而Luminopia One對該亞組群體同樣有效。研究期間,患者對Luminopia One的中位依從率為88%,顯著高於眼罩療法依從率(48%)。
這是十多年來首個取得成功的新型弱視治療隨機對照試驗,為數百萬患者提供了支援潛在新療法的有力證據。與當前的治療方案不同,Luminopia One是一種研究性數字治療方法,可讓患者觀看經過視覺修改的電視節目和電影,以改善他們的視力。2021年10月,FDA批准Luminopia One用於4-7歲弱勢兒童的治療。
NO.7 度伐利尤單抗聯合替西木單抗治療肝細胞癌的III期HIMALAYA研究
公司:阿斯利康
臨床意義:首個一線治療肝細胞癌改善OS的雙免疫療法,也是目前最長OS的療法
2021年10月15日,阿斯利康宣佈度伐利尤單抗聯合替西木單抗一線治療晚期肝細胞患者的III期HIMALAYA研究中達到了OS主要終點。
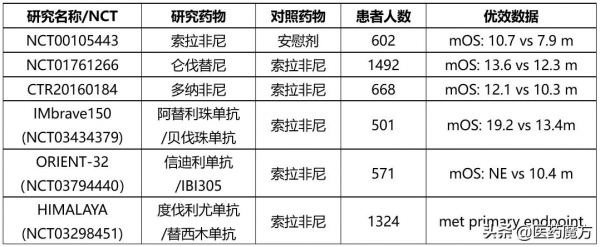
HIMALAYA研究採用隨機、開放標籤設計,在16個國家的190箇中心入組了1324例不可手術的晚期肝細胞癌患者,患者此前均未接受過系統治療,並且也不適合接受區域性療法。患者隨機分組,分別接受Imfinzi單藥治療、STRIDE療法(在Imfinzi 1500mg每4周1次常規治療基礎上新增使用一劑tremelimumab 300mg)和索拉非尼。研究的主要終點是STRIDE療法 vs 索拉非尼的OS,關鍵次要終點包括Imfinzi vs 索拉非尼的OS,STRIDE療法組和Imfinzi 組的ORR和PFS。最終結果顯示,STRIDE療法相比單獨使用索拉非尼,可以使患者的總生存期(OS)實現統計學意義和臨床意義上的顯著改善,同時也顯示出了較好的安全性,組合療法並不會增加嚴重肝毒性風險。此外,在HIMALAYA研究中,有趨勢表明Imfinzi有更好的耐受性。
索拉非尼曾是唯一的肝細胞癌臨床一線標準治療藥物,自其獲批上市的10多年來,一直沒有藥物能夠單藥一線“頭對頭”打敗索拉非尼。近兩年,肝細胞癌臨床治療不斷進步,侖伐替尼、多納非尼先後在一線“頭對頭”研究中顯示優效或非劣;阿替利珠單抗聯合貝伐珠單抗、信迪利單抗聯合貝伐珠單抗(達攸同)也使肝癌患者能夠受益免疫治療,開啟了肝癌治療的新里程碑。
當然,度伐利尤單抗聯合替西木單抗對於肝細胞癌的改善程度,仍有待HIMALAYA詳細資料披露。不過,2021年阿替利珠單抗聯合貝伐珠單抗更新了總生存期資料,更是將肝癌OS資料進一步提高,或將為後續肝癌藥物開發訂立新標準。
NO.8 VX-880治療1型糖尿病(T1D)的I/II期臨床研究
公司:Vertex
臨床意義:幹細胞為治癒1型糖尿病帶來希望
2021年10月18日,Vertex Pharmaceuticals宣佈,其來源於幹細胞的全分化胰島細胞替代療法,在1/2期臨床試驗的首例1型糖尿病患者(T1D)中獲得積極資料。在接受單劑治療後第90天時,患者恢復胰島素分泌,減少了每天胰島素使用量的91%。
VX-880是一種同種異體幹細胞衍生的、完全分化的胰島細胞療法,有可能透過恢復胰島細胞功能來恢復身體調節葡萄糖水平的能力,包括葡萄糖響應胰島素的產生。VX-880 透過注入肝門靜脈遞送,需要長期免疫抑制治療以保護胰島細胞免受免疫排斥。
Brian Shelton有可能是第一個治癒的1型糖尿病患者。6月29日,Brian Shelton接受了細胞輸注,治療後第90天,空腹C肽為280 pmol/L,反映基礎胰島素生成的恢復,並在混合餐耐受性試驗(MMTT)刺激後增加至峰值560 pmol/L,表明 VX-880 恢復了葡萄糖反應性胰島素產量。同樣在第90天,HbA1c從基線時的8.6%改善至7.2%,每日胰島素劑量從VX-880 治療前的每天34個單位減少到平均每天2.9個單位,反映每日外源性胰島素使用量減少了 91%。
Brian Shelton
儘管本次試驗尚處於早期,而且只有1名患者資料,但已經窺見VX-880的巨大潛力。加州大學洛杉磯分校的糖尿病專家Peter Butler博士認為這是類似於100年前胰島素首次出現時的奇蹟。不過,專家也認為需要謹慎,該項研究仍在繼續,以確認療效能夠不止在一個患者身上成功,以及這種療效能持續多久。
NO.9 Paxlovid治療新冠感染的II/III期EPIC-HR研究
公司:輝瑞
臨床意義:目前最有效的新冠小分子藥物
2021年11月5日,輝瑞宣佈,其在研新型COVID-19口服抗病毒候選藥物Paxlovid (PF-07321332; ritonavir) 在一項用於治療非住院、具有發展成重症疾病的高風險成人COVID-19感染患者的隨機、雙盲II/III期EPIC-HR研究的期中分析中顯著降低了住院和死亡風險。
預先設定的中期分析顯示,在症狀出現三天內接受治療的患者中,與安慰劑相比,Paxlovid可使COVID-19相關的住院或因任何原因死亡的風險降低89%(主要終點);隨機分組後Paxlovid組有0.8%患者住院至第28天(3/389住院,無死亡),而安慰劑組有7.0%患者住院或死亡(27/385住院,7人死亡)(p<0.0001)。12月,EPIC-HR研究更新的最終資料顯示,與安慰劑相比,Paxlovid可使COVID-19相關的住院或全因死亡風險降低89%(3日內給藥)和88%(5日內給藥)。
當然,Paxlovid並非首個顯示療效的小分子口服藥物。默沙東此前公佈了molnupiravir治療輕中度COVID-19的Ⅲ期試驗MOVe-OUT(NCT04575597)中期資料。研究結果顯示,molnupiravir將住院或死亡風險降低50%,並基於該資料已經在英國獲批上市,FDA和EMA也在對其滾動提交的上市申請進行審查。不過,11月最新的資料顯示,Molnupiravir在1433 名受試者中,僅將住院或死亡風險降低了30%。
儘管FDA專家顧問小組以13票贊成、10票反對的投票結果支援默沙東新冠口服藥Molnupiravir的緊急使用授權,但僅限於在高風險人群範圍中使用,並且FDA不推薦在孕婦中使用。輝瑞也已經先後向FDA和EMA提交緊急使用授權申請,並在12月16日獲得EMA人用藥品委員會(CHMP)建議在高危人群中提前使用的支援。
就在昨日(12月22日),輝瑞宣佈美國FDA已批准其新型COVID-19口服抗病毒候選藥物Paxlovid 的緊急授權申請(EUA),用於治療非住院、具有發展成重症疾病高風險的輕中度、12歲及以上兒童和成人COVID-19感染患者。
NO.10 Tabelecleucel治療EBV+PTLD的III期ALLELE臨床研究
公司:Atara
臨床意義:PTLD或將迎來首個療法,同種異體現貨型細胞療法上市
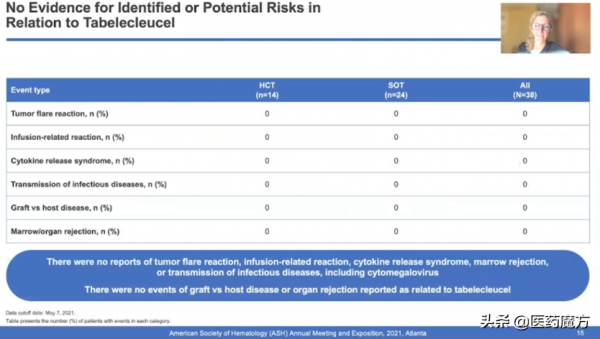
2021年12月,在第63屆美國血液學會 (ASH)年會上,Tabelecleucel首次報告了治療嚴重Epstein-Barr病毒 (EBV)驅動性疾病,包括移植後淋巴組織增生性疾病 (EBV+PTLD)的臨床研究(ALLELE)資料及總生存期進展。
移植後淋巴組織增生性疾病(PTLD)尚無批准療法,EBV病毒驅動了約50%-80%的移植後淋巴增殖性疾病,特別是移植後1-2年內早發性的PTLD。實體器官移植(SOT)和同種異體造血細胞移植 (HCT)後EBV+PTLD的初始管理可能包括減少免疫抑制和/或利妥昔單抗±化療(CT)。在HCT的復發或難治EBV+PTLD的患者中,利妥昔單抗治療±化療失敗後的中位OS約為0.7個月;而在復發難治SOT患者中,利妥昔單抗治療±化療失敗後的中位OS約為4.1個月。
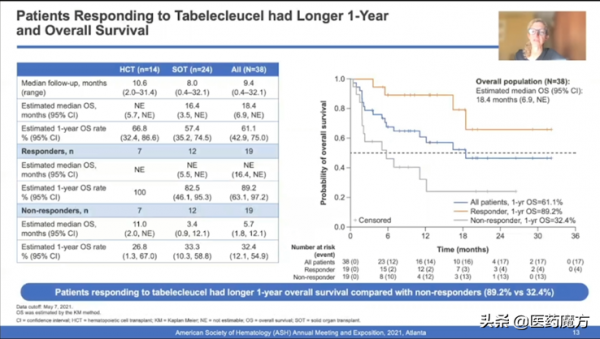
Tabelecleucel是一種臨床在研的現貨型(off-the-shelf)、同種異體EBV特異性T細胞免疫療法。在ALLELE研究中,接受Tabelecleucel治療的患者,ORR達到50.0%,26.3%(n=10)的患者實現CR。全人群的mOS達到18.4個月(SOT為16.4個月,HCT尚未達到),對治療有響應的患者生存獲益顯著(1-Year OS: 89.2% vs 32.4%)。
安全性方面,雖然也有3級及以上不良事件,但Tabelecleucel治療耐受性良好。在這些病重、治療難治性和免疫功能低下的患者中,沒有輸注相關反應、細胞因子釋放綜合徵、感染性疾病(包括鉅細胞病毒)以及與Tabeleclel相關的移植物抗宿主病或器官排斥事件報告。
CAR-T是一種已經成功實現上市的新型細胞療法,對改善疾病治療具有積極意義。不過,生產成本過高、患者T細胞功能較差、製備週期長、療效不能持久等問題也備受爭議。業界認為,來自健康人群的同種異體現貨型療法有望成為解決這些問題的策略。
當然,除了上述臨床進展,2021年仍有多項突破性或“錦上添花”的臨床研究取得積極進展。包括:舒格利單抗的GEMSTONE-302研究,使序貫放化療患者也能從免疫療法受益;VX-147治療APOL1介導的局灶性節段性腎小球硬化的II期概念驗證試驗,或將助力首個藥物獲批;GLP-1R和GIPR雙重激動劑Tirzepatide多項SURPASS研究取得陽性結果進展,糖尿病治療格局又將生變;Nirsevimab單劑量預防嬰兒和兒童呼吸道合胞病毒 (RSV)感染的MEDLEY研究,也被評為2022年有望重塑醫學的研究進展。
凡此種種,不勝列舉。2021年還有哪些臨床研究如“素月流空”般閃現於腦海,也不妨留言討論。