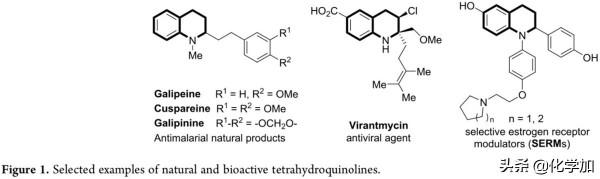
含氮雜環化合物作為一類重要的結構單元,不僅可用於合成有機催化劑和手性配體,還可廣泛存在於生物活性分子中,尤其是四氫喹啉,作為一類重要的氮雜環化合物,是許多天然產物和藥物活性分子的基本結構骨架(Figure 1)。近年來,化學家一直在尋求含氮雜環化合物的高效合成方法,如透過過渡金屬催化芳香胺與不飽和烷烴的級聯C(sp2)-H/N-H來構建含氮雜環骨架,但由於苯胺鄰位C(sp2)-H難以活化導致該方法並不適用於構建四氫喹啉環。因此,發展高效合成四氫喹啉環化合物的方法長期以來一直是化學家的研究重點。
近日,蘇州大學的徐信教授課題組報道了Sc-催化苯胺與聯烯或二烯的[3+3]環化反應,成功實現了四氫喹啉骨架化合物的高效合成。相關成果發表在ACS Catal.上(DOI: 10.1021/acscatal.1c04657)。
(圖片來源:ACS Catal.)
基於課題組的前期研究,作者以N-甲基苯胺(5a)與α-甲基苯聯烯(6a)作為模型底物,對稀土金屬催化劑進行了篩選(Table 1)。首先,作者發現在[Ph3C][B(C6F5)4]和甲苯條件下,以Sc複合物1和2為催化劑時,反應幾乎不發生。接著,作者在相同反應條件下,將複合物1中的大位阻配體換成苯時,發現反應能以73%的NMR產率得到目標產物7a。然後,作者繼續對稀土金屬進行篩選,發現當以4、AlCl3、Sc(OTf)3和Y(OTf)3為催化劑時,並沒有觀察到目標產物的生成。最後,作者又嘗試不加入[Ph3C][B(C6F5)4]和降低底物比例時,反應產率為0%-36%。經過篩選,作者確定了3為催化劑(10mol%)、[Ph3C][B(C6F5)4]為配體(10 mol%)和甲苯為溶劑的反應條件。
(圖片來源:ACS Catal.)
在最優反應條件下,作者考察了苯胺底物的官能團相容性(Table 2)。結果顯示,當R1為甲基時,苯環對位帶有甲基、乙基、叔丁基、苯基和鹵素時,反應能以66%-96%的分離產率得到目標產物(7a-7g),而苯環鄰位帶有甲基或雙甲基時,反應能以57-92%的產率得到產物7h-7i。隨後,作者又繼續考察了N-取代基R1的適用範圍。結果表明,當R1為甲基、乙基、甲苯基或無取代基時,反應能以51%-96%的分離產率得到目標產物(7j-7s)。
(圖片來源:ACS Catal.)
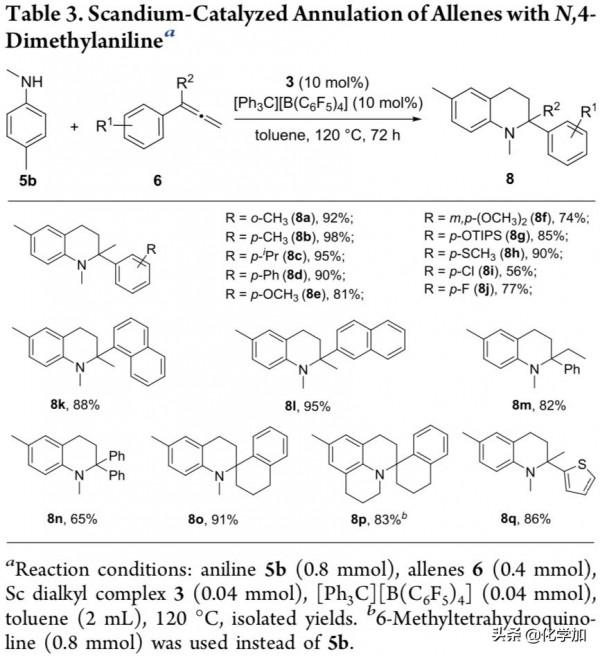
作者繼續考察了苯聯烯底物的官能團相容性(Table 3)。結果顯示,當R2為甲基時,苯環帶有甲基、異丙基、苯基、甲氧基、甲硫基和鹵素時,反應能以56%-98%的分離產率得到目標產物(8a-8j)。除苯聯烯之外,萘聯烯、噻吩聯烯和螺環聯烯底物同樣適用於該反應,能以83%-95%的產率得到目標產物(8k-8l, 8o-8q)。此外,當R2為乙基、苯基時,該反應同樣能夠以82%和65%的產率得到目標產物(8m-8n)。
(圖片來源:ACS Catal.)
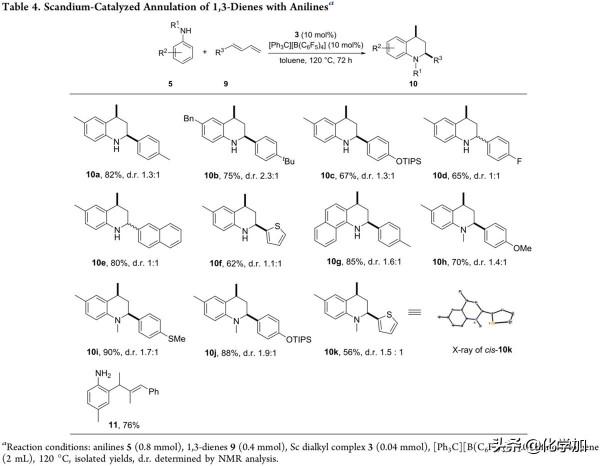
共軛1,3-二烯底物被廣泛用於各類環加成反應,作者為了研究1,3-二烯是否適用於C−H/N−H環化以構建取代四氫喹啉,於是以對甲苯胺和1-(4-甲基苯基)-丁二烯為底物,發現在標準條件下,反應能以82%的分離產率得到目標化合物10a(Table 4)。因此,作者開始考察共軛1,3-二烯底物的官能團相容性(Table 4)。結果顯示,1,3-二烯帶有叔丁基苯、TIPS保護苯酚、氟苯、萘和噻吩等取代基時,反應能以62%-85%的分離產率和低非對映選擇性得到目標產物(10b-10g),而R1為甲基取代時,反應同樣適用於含有甲氧基苯、甲硫基苯、TIPS保護苯酚和噻吩等取代基的1,3-二烯底物,能以56-90%的產率得到產物10h-10k。此外,當R3為大位阻取代基時,反應僅以76%的產率得到鄰位烯丙基化產物(11)。
(圖片來源:ACS Catal.)
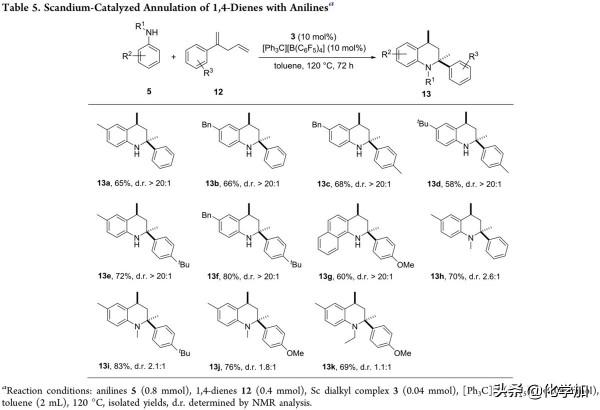
緊接著,作者又進一步研究了1,4-二烯的反應適用性(Table 5)。結果表明,當R3為氫或甲基、叔丁基和甲氧基等取代基時,反應能以58%-80%的中等產率和優異的非對映選擇性(dr > 20:1)得到目標產物(13a-13g)。此外,二級胺底物同樣適用於該反應,能夠以69%-83%的分離產率得到目標產物(13h-13k),但其非對映選擇性顯著降低。
(圖片來源:ACS Catal.)
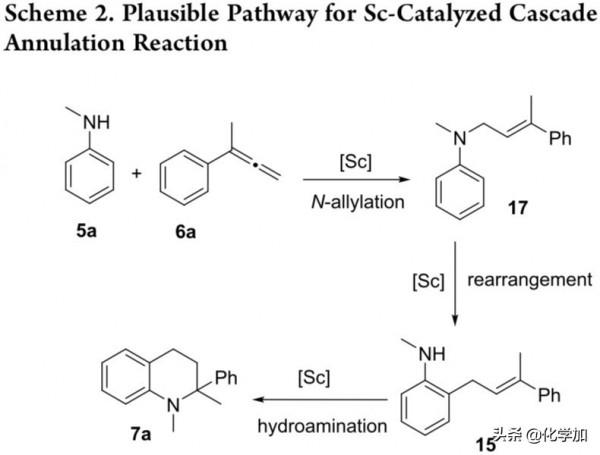
接下來,作者利用一系列對照實驗對反應機理進行了研究(Scheme 1)。首先,作者利用Sc複合物3、[Ph3C][B(C6F5)4]和N-甲基苯胺(5a)在標準條件下反應,發現透過質子交換反應原位得到複合物14(Scheme 1a)。同時,作者利用5a和6a在複合物14的條件下反應,發現反應能以56%的產率得到目標產物7a(Scheme 1b),說明覆合物14是反應的催化中間體。接著,作者在相同底物條件下,降低反應溫度,發現反應以71%的產率得到鄰位烯丙化產物15(Scheme 3c)。此外,作者以2,6-二甲基苯胺為底物,發現反應透過級聯羥胺/Hofmann-Martius重排以73%的產率得到對位烯丙化產物16(Scheme 1d)。而在標準條件下,以鄰位烯丙化產物15為反應底物時,反應能以90%的產率得到四氫喹啉產物,說明鄰位烯丙化產物15是關鍵的的反應中間體(Scheme 1e)。最後,作者利用氘代苯胺作為底物,以62%的產率得到氘代產物15,且在三個不同取代基觀察到氘代的存在,表明催化過程存在N-H活化到鄰位C(sp2)-H的變化(Scheme 1d)。
(圖片來源:ACS Catal.)
基於上述研究,作者認為反應涉及到級聯N-烯丙基化-Hofmann-Martius重排/羥胺化過程(Scheme 2),為了驗證這一想法,作者利用NMR對反應進行了研究(Figure 2)。結果顯示,在反應早期階段,產物以鄰位烯丙化產物15和N-烯丙基化產物17為主,而隨著反應時間的推移,N-烯丙基化產物17 透過重排反應轉化成鄰位烯丙化產物15。而當反應溫度升高至120 °C時,隨著目標產物7a的生成,鄰位烯丙化產物15的含量顯著下降,並伴隨著少量副產物7a’的生成。
(圖片來源:ACS Catal.)
(圖片來源:ACS Catal.)
最後,作者對該反應的實用性進行了研究(Scheme 3)。首先,作者以5a和6c為起始原料,在克級規模下,經[3+3]環化以96%的產率得到目標產物8b(Scheme 3a)。然後,作者以10a為起始原料,以B(C6F5)3為催化劑,能夠以80%的產率得到喹啉衍生物18(Scheme 3b);此外,以8r和7q為反應底物,分別經Pd-催化的C-N交叉偶聯和Buchwald-Hartwig反應,以85%和68%的產率得到化合物19和20。最後,作者以8s為反應底物,經Pd-催化的C-N交叉偶聯和TBAF脫保護,能夠以兩步67%的產率得到選擇性雌激素受體調節劑21。實用性研究說明了取代四氫喹啉產物可以作為中間體來合成其他結構,進一步證明了該合成方法的實用價值。
(圖片來源:ACS Catal.)
總結:蘇州大學徐信教授課題組報道了一類Sc-催化的苯胺與聯烯和二烯的[3+3]環化反應,成功實現了四氫喹啉骨架化合物的高效合成。該反應條件溫和、官能團相容性好、非對映選擇性良好,且產物可透過反應衍生為其他常見的官能團,在藥物化學和有機合成中具有實用性。