2021年9月16日至21日,2021年歐洲腫瘤內科學會(ESMO)年會採用線上會議的方式舉行。作為全球最具影響力的腫瘤學術平臺之一,ESMO年會每年都會匯聚全球腫瘤專業人士,共同分享腫瘤領域的前沿研發趨勢和進展。
乳腺癌常被稱為“粉紅殺手”,其發病率位居女性惡性腫瘤的首位,男性乳腺癌較為少見。隨著醫療水平的提高,乳腺癌已成為療效最佳的實體腫瘤之一。截至目前,乳腺癌已公佈有多項臨床研究。本期【醫悅匯】整理乳腺癌的部分熱點研究,以饗讀者!
晚期乳腺癌
1 曲妥珠單抗治療HER2+轉移性乳腺癌(mBC)患者與曲妥珠單抗(T-DXd)(T-DM1):隨機III期DESTINY-Breast03研究的結果
背景
T-DXd是一種靶向HER2的抗身體藥物偶聯物,根據DESTINY-Breast01(nct0324849201)的結果,被批准用於晚期HER2+mBC患者。這是 DESTINY-Breast03 (NCT03529110) 的第一份報告,是一項多中心、開放標籤、隨機III期研究,比較 T-DXd 與 T-DM1 在先前接受曲妥珠單抗和紫杉烷治療的 HER2+ mBC 患者中的療效和安全性。是首次報道的T-DXD在BC中的隨機研究。
方法
Pts被隨機分為1:1。主要終點是透過盲法獨立中心審查(BICR)進行的無進展生存期(PFS)。次要終點包括總生存率(OS)、客觀反應率(ORR)、反應持續時間、研究者的PFS和安全性。
結果
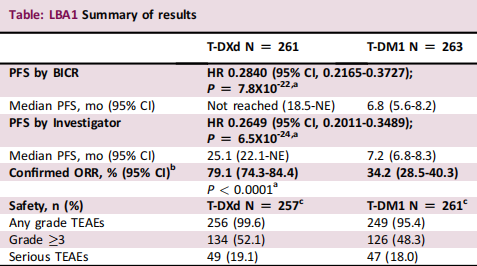
截至2021年5月21日,隨機抽取524例患者。中位年齡為54歲(範圍為20-83歲)。PFS的危險比(HR)為0.2840(P¼7.8x10-22);T-DXd未達到PFS中值,而T-DM1的PFS值為6.8個月。T-DXd的12個月OS事件發生率估計為94.1%(95%CI、90.3-96.4),T-DM1的估計為85.9%(95%CI、80.9-89.7);HR:0.5546(95%CI,0.3587-0.8576;P¼0.007172的顯著性未跨越預先規定的邊界)。T-DXd的中位治療時間為14.3個月(範圍為0.7-29.8),T-DM1為6.9個月(範圍為0.7-25.1);TEAEs發生率相似。兩組均未發生與藥物相關的死亡。經裁定的藥物相關間質性肺病 (ILD) 發生在 10.5% 的 T-DXd 患者(大多數 [9.7%] 級1/2;0 級 4/5)與 1.9% 的 T-DM1患者(所有等級 1/2)中。
T-DXd在既往使用曲妥珠單抗和紫杉烷治療HER2+mBC的患者中,與T-DM1相比,PFS具有高度統計學意義和臨床意義的改善。這些資料證實,T-DXd具有可耐受性,毒性可控。且在與預處理的患者中進行的研究相比ILD 譜有顯著改善。本項研究將導致 HER2+ mBC 治療的正規化轉變。
2 POSEIDON 隨機II期試驗:Tamoxifen(TAM)+taselisib or placebo (PLA)用於激素受體陽性(HR+)/HER2轉移性乳腺癌(MBC)患者
背景
Taselisib是fPI3K類αβγ亞型的口服抑制劑,已與TAM聯合具有臨床活性(Baird R et al,CCR2019)。
方法
POSEIDON 是一項國際化、多中心、隨機 (1:1) 的 II 期試驗,在先前內分泌治療 (ET) 後的 HR+/HER2- MBC 患者中使用 TAM +taselisib or PLA。允許進行交叉處理。主要終點:無分層無進展生存期(PFS;區域性評估)。次要終點:安全性、RECIST1.1總緩解率(ORR;完全緩解[CR]+部分緩解[PR])、臨床獲益率(CBR;CR+PR+穩定疾病>6個月)和總生存期(OS)。180名患者需要檢測到PFS恆定風險比(HR)為0.64(ß¼90%,雙側a¼0.2)。因Covid-19提前關閉,功率降至83%。
結果
152例患者被納入(中位年齡63歲),中位隨訪26.4個月(m)。將 taselisib 新增到 TAM 將中位 PFS 從 3.2 增加到 4.8m(未分層 HR 0.62,95%CI 0.43-0.93,p=0.02;分層 HR 0.68,95%CI 0.4-1.2,p=0.16),獨立於 CA3 地位。在 taselisib 組中,ORR 11.8% (95%CI 5.6-21.3) 和 CBR 22.4% (95%CI 13.6-33.4);在 PLA 組中,ORR 為 2.6% (95%CI 0.3-9.2) 和 CBR 14.5% (95%CI 7.5-24.4)。停用其他藥物taselisib/PLA的原因:毒性22%/4%,疾病進展性55%/67%,其他(主要是新冠肺炎)23%/29%。taselisib組常見的不良事件(AEs):腹瀉(36%)、噁心(35%)、高血糖(28%)。PLA組常見的不良事件:噁心(21%)、疲勞(16%)。G3-5AEs更常見(44%對5%,p<0.01),主要為腹瀉(11%)、高血糖(5%)和經肌膜炎(5%)。
在TAM中加入PFS增加了HR+/HER2-陰性MBC患者的PFS,但該方案的耐受性較差。結合ET和PI3K-AKT通路抑制,使用具有更好的治療指標的藥物,值得在最可能受益的乳腺癌亞組中進行進一步的研究。
3 一項旨在評估依維莫司在轉移性乳腺癌(mBC)(desiree)患者中誘導劑量增加的耐受性的多中心、隨機性、雙盲性II期研究
背景
在依西美坦中加入依維莫司可改善HR+/經非甾體芳香化酶抑制劑(NSAI)的HER2-mBC預處理的患者的預後。引發粘膜炎的主要原因之一是停用依維莫司。為了減少粘膜炎的發生,DESIREE 研究了依維莫司劑量遞增方案的使用。
方法
DESIREE是一項II期、多中心、隨機性、雙盲性安慰劑對照試驗,用於HR+/HER2-mBC和NSAI後進展或復發的患者。患者被隨機分配至依維莫司10毫克/天(EVE-10 毫克),持續24周或依維莫司的劑量遞增(2.5 毫克/天,第1周;5毫克/天,第2周;7.5 毫克/天,第3周;10 毫克/天,第 4-24 周)(EVE-esc) 加入依西美坦。主要終點是在治療開始後12內周首次發生粘膜炎級別(G)≥2的發生率。次要終點包括臨床獲益率(CBR)、相對總劑量強度(RTDI)、安全性、生活質量(QoL)。
結果
160例患者被隨機分組(2015年6月-2020年10月),156例開始治療(n¼80EVE-esc,n¼76EVE-10mg)。中位年齡為64歲(範圍33-85歲)。基線時,EVE-esc的56.3%和EVE-10mg的48.7%超重或肥胖(p¼0.423),56.3%接受肝+(p¼0.081),62.5%和51.3%接受mBC治療(p¼0.196)。在EVE-esc中,治療後12周內粘膜炎的G≥2發生率顯著降低(28.8vs46.1%,p¼0.039)。根據年齡、ECOGPS、BMI和既往mBC治療系的數量進行調整後,這種效應保持了統計學意義(OR¼0.41[95%CI0.20-0.82],p¼0.012)。這裡對肺炎或皮疹等其他非血液學毒性沒有影響。中位RTDI為91.1vs80.0%(p¼0.329)。前3周的停用在EVE-10mg中更為頻繁(6.3vs15.8%,p¼0.073)。CBR無顯著差異(32.5%vs44.7%p¼0.139)。前瞻性捕獲的生活質量無顯著性差異。
結論
DESIREE達到其主要研究目標,表明依維莫司劑量遞增方案可成功用於以防止粘膜炎G≥2的發生,而不影響療效的HR+/HER2-mBC患者。
4 III期SYD985.002/TULIP試驗比較[vic-]曲妥珠單抗Duocarmazine與醫生選擇治療預治療的HER2陽性的區域性晚期或轉移性乳腺癌患者的主要結果
背景
[vic-]曲妥珠單抗Duocarmazine(SYD985,Byondls B.V.)是一種新型的HER2靶向抗人體藥物偶聯物,由曲妥珠單抗與含有雙卡黴素的連線藥物結合組成。YULIP評估了SYD985對晚期HER2陽性乳腺癌的療效。
方法
TULIP 試驗 (NCT03262935) 隨機分配HER2陽性區域性晚期或轉移性乳腺癌 (MBC) 患者,這些患者既往接受過2種以上MBC方案或既往採用T-DM1進行MBC治療,SYD985之間的比例為2:1(1.2 mg/kg,每三週一次)和醫生選擇的(PC)化療。主要終點是無進展生存期(PFS)。在P<0.05的顯著性水平上,該試驗檢測到的危險比(HR)為0.65。次要終點為研究者評估的PFS、總生存期(OS)、客觀反應率(ORR)和健康相關生活質量(HRQoL)。
結果
來自11個國家的437例患者被隨機分配到SYD985(n¼291)或PC(n¼146)兩個試驗組。中位年齡為56歲,既往接受MBC治療的中位年數為4年 [範圍1-16]。中心回顧的SYD985的中位PFS為7.0個月[95%CI5.4-7.2],PC為4.9個月[4.0-5.5](HR0.64[0.49-0.84];p¼0.002]。研究者評估的PFS也有顯著改善(6.9個月[6.0-7.2]和4.6個月[4.0-5.6];HR0.60[0.47-0.77];p<0.001)。在第一次OS分析中,HR為0.83[0.62-1.09];p¼為0.153。ORR和HRQoL差異均無顯著性差異。SYD985最常報告的不良事件是結膜炎(38.2%)、角膜炎(38.2%)和疲勞(33.3%),PC的不良事件為腹瀉(35.8%)、噁心(31.4%)和疲勞(29.9%)。據報道,接受SYD985治療的患者中有(5.6%或5.2%)為間質性肺病或肺炎,包括2例5級事件。SYD985組中導致停藥的不良事件(SYD98535.4%,PC10.2%)主要與眼部障礙(20.8%)或呼吸系統障礙(6.3%)有關。
結論
與標準PC相比,SYD985治療顯著改善了PFS,並可能為預治療的區域性晚期或轉移性HER2陽性MBC患者提供一種新的治療選擇。
5 KEYNOTE-355:一項轉移性TNBC一線派姆單抗+化療對比安慰劑 +化療的隨機性、雙盲性III期研究的最終結果
背景
先前對KEYNOTE-355(NCT02819518)的中期分析顯示,一線派姆單抗+化療對比安慰劑(表達PD-L1(CPS10)的轉移性TNBC患者+化療顯著改善(HR,0.65,95%CI,0.49e0.86;單側P¼0.0012[偏值邊界,0.00411])我們提出了OS的雙主要終點以及其他研究終點的最終結果。
方法
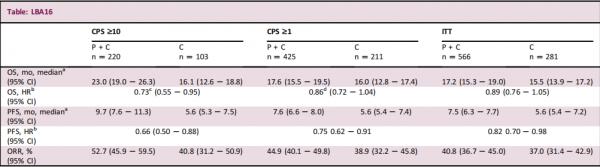
847例新生轉移或≥6例DFI患者被隨機分為2:1接受+化療(裸紫杉醇、紫杉醇或吉西他濱卡鉑)或+化療35次以上,或直到病情進展或無法忍受毒性的出現。按化療型別(紫杉烷或吉西他濱卡鉑)、PD-L1狀態(CPS≥1或<1)和同類化療(是或否)輔助治療進行分層。PDL1+腫瘤患者(CPS≥10和≥1)和所有患者(ITT)的雙主要終點是PFS(RECIST v1.1)和OS。ORR是一個次要的端點。在整個研究過程中監測AEs,並根據NCI CTCAE v4.0進行分級。
結果
截至2021年6月15日,中位隨訪時間為44.1個月。與單獨化療相比,Pembro+化療顯著改善了CPS≥10腫瘤患者的OS。Pembro+化療對CPS≥1腫瘤患者的顯著OS獲益的p值邊界沒有得到滿足,也沒有在ITT中進行正式的測試。Pembro+化療對PFS的益處與之前的結果一致。Pemblo+化療改善了CPS≥10腫瘤患者的ORR。對於所有終點,Pemblo處理效果隨著PD-L1的富集而增加。3-5級Pembro+化療組的治療相關AE發生率為68.1%(2例死亡),而化療組為66.9%(0例死亡)。
結論
在先前未經區域性治療的患者中,Pembro +化療顯示OS與單獨化療相比具有統計學意義和臨床意義的改善。腫瘤表達 PD-L1(CPS >10)的複發性不能進行手術或轉移性的TNBC。目前沒有發現新的安全隱患。
6 總生存期 (OS) 來自III期 MONALEESA-2 (ML-2) 試驗的結果,該試驗針對激素受體陽性/人表皮生長因子受體 2 陰性 (HR+/HER2L) 晚期乳腺癌 (ABC) 治療的絕經後患者 (pts) 內分泌治療 (ET) ± ribociclib (RIB)
背景
ML-2(NCT01958021)是一項隨機III期臨床試驗,研究一種週期蛋白依賴性激酶4/6抑制劑(CDK4/6i)+letrozole(LET)與placebo(PBO)+LET治療絕經後HR+/HER2—ABC患者的一線(1L)RIB。ML-2先前報道了RIB+LET與RIB+LET的無進展生存期(PFS;主要終點)有統計學意義的改善(HR,0.56;95%CI,0.43-0.72)。我們報告了協議指定的OS的最終分析(關鍵的次要終點)。
方法
絕經後HR+/HER2—ABC患者隨機1:1接受RIB+LET或PBO+LET。如果Pts既往接受過CDK4/6i、化療(CT)或ET治療,則被排除在外。OS採用分層環秩檢驗進行評估,並採用KaplaneMeier方法進行總結。該方案規定的分析計劃在400個死亡數後進行。
結果
意向治療人群包括668例(RIB:334;PBO:334)。在資料截止時(2021年6月10日),47名患者仍在接受治療(RIB:30[9.0%];PBO:17[5.1%]),中位隨訪時間為第79.7個月。評估400例死亡病例後(RIB:181[54.2%];PBO:219[65.6%])。RIB+LET與PBO+LET相比有顯著的OS獲益(中位數,63.9和51.4個月;HR,0.76;95%CI,0.63-0.93;P¼。004),符合統計學意義的邊界。預計RIB的6年OS率為44.2%,而PBO為32.0%。首次CT的時間(中位數50.6個月 vs 38.9個月;HR、0.74、95%CI、0.61-0.91)和無CT生存期(中位數39.9個月vs 30.1個月;HR、0.74;95%CI、0.62-0.89)對RIB與PBO有一定的益處。
結論
在停止研究治療的患者中,分別有87.8%和90.2%的患者接受了RIB和PBO的後續抗腫瘤治療,21.7%和34.4%患者接受了隨後的CDK4/6i治療。目前沒有觀察到新的安全隱患。
我們將持續更新更多的2021 ESMO大會腫瘤熱點研究,敬請期待!
版權宣告
本文版權歸醫悅匯所有。歡迎轉發分享,其他任何媒體如需轉載或引用本網版權所有內容,須獲得授權,且在醒目位置處註明“轉自:醫悅匯”。