9月24日,中華醫學會第二十四次全國神經病學學術會議在珠海如火如荼地進行中。本次學術專場誠邀
首都醫科大學附屬北京天壇醫院的張巍教授擔任大會的主持人,並特邀中南大學湘雅醫院的沈璐教授就“阿爾茨海默病(AD)抗β澱粉樣蛋白治療進展”做了精彩的主題報告
。本文將對精彩內容進行簡要總結,以饗讀者。
Aβ聚集導致的澱粉樣斑塊是AD的病理特徵之一
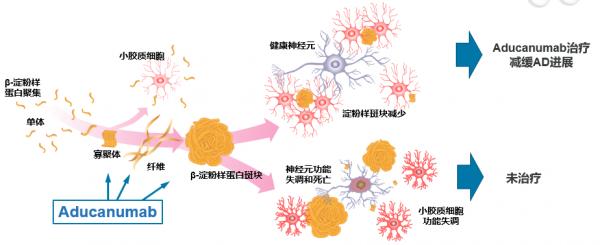
Aβ聚集導致的澱粉樣斑塊是AD的病理特徵之一。從生物學角度來看,AD被定義為兩個標誌性的蛋白病變:神經元外β-澱粉樣蛋白(Aβ)斑塊和神經元內神經纖維纏結(由過度磷酸化的tau蛋白組成)。而大腦中的Aβ病理改變導致的病變包括炎症反應、突觸功能障礙和神經纖維纏結(見圖1)。
FDA加速批准Aducanumab成為全球首個及唯一針對AD明確病理機制的治療方法
2020年8月7日,美國FDA宣佈Aducanumab生物製劑許可申請(BLA)獲得優先審查。2021年6月7日,FDA透過加速審批途徑批准Aducanumab用於AD患者治療,並於2021年7月8日更新了Aducanumab的說明書,將藥物適用者限定為AD源性MCI以及輕度AD患者。
Aducanumab是在中國倉鼠卵巢細胞系(41-3D17)中表達的重組人抗體,純化後獲得高純度,並製成液體制劑。Aducanumab的研發利用了反向轉化藥物專利技術平臺(Neurimmune,瑞士,蘇黎世),它透過收集健康老年人和認知功能下降異常緩慢老年人的記憶B細胞,反向識別出對Aβ聚集體具有反應性的抗體克隆,最終重組表達形成Aducanumab。Aducanumab可針對AD病理機制,清除Aβ寡聚體、纖維及澱粉樣蛋白斑塊,從而減緩疾病的進展(見圖2)。
Aducanumab臨床研發歷程
1. PRIME研究——探索Aducanumab最佳劑量
PRIME研究是一項為期12個月的隨機、多中心、雙盲、安慰劑對照研究,該研究主要是在AD患者中評估Aducanumab的安全性、耐受性、藥代動力學和藥效學作用。該研究的主要終點是評估Aducanumab的安全性和耐受性,次要終點是血清PK、免疫原性、第26周澱粉樣蛋白PET的改變,探索性終點包括CDR-SB評分、MMSE評分以及第54周澱粉樣蛋白PET的改變。
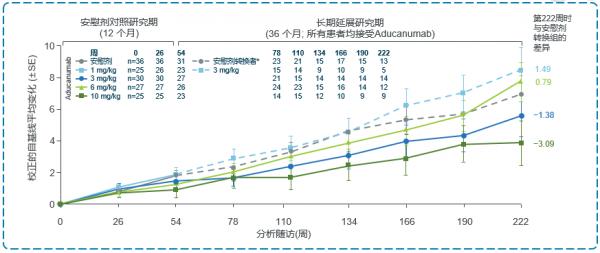
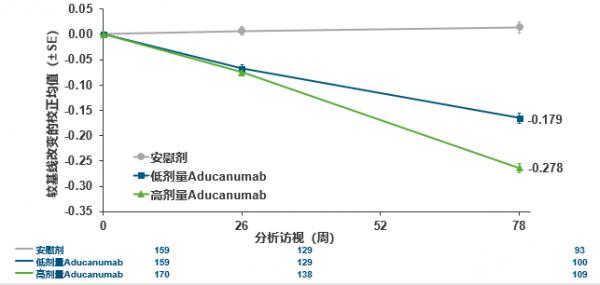
該研究結果顯示,Aducanumab可以有效減少澱粉樣斑塊,呈劑量和時間依賴性(見圖3)。延長期48個月研究的固定劑量分析顯示:Aducanumab可長期有效穩定清除Aβ斑塊(見圖4)且可明顯延緩認知功能的臨床衰退(見圖5)。
注:縱座標表示Aducanumab對Aβ斑塊的影響——基於PET SUVR測量結果
注:縱座標表示Aducanumab對臨床衰退的影響——基於CDR-SB測量結果
2.
ENGAGE和EMERGE研究——PRIME基礎上的設計最佳化,以提高Ⅲ期研究的成功機率
Aducanumab的2項Ⅲ期研究—ENGAGE和EMERGE研究,為隨機、雙盲、安慰劑對照研究,為期18個月。研究共納入20個國家、348家研究中心、3285例早期阿爾茨海默病(阿爾茨海默病所致MCI + 輕度阿爾茨海默病痴呆)患者,研究的主要終點為18個月時的CDR-SB評分,次要終點為MMSE、ADAS-Cog13、ADCS-ADL-MCI評分,子研究終點為澱粉樣蛋白PET、tau蛋白PET、CSF疾病相關生物標誌物。
3. ENGAGE和EMERGE研究的有效性結果
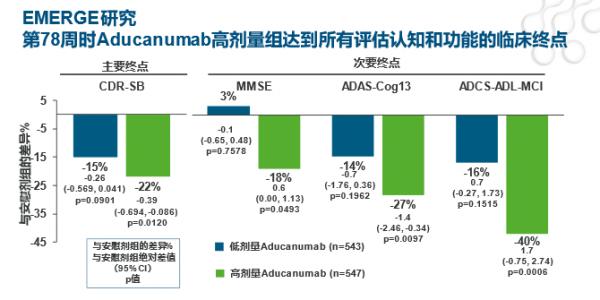
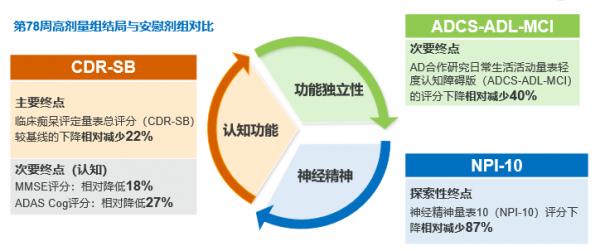
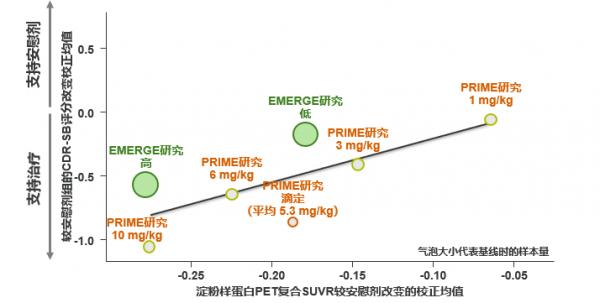
EMERGE研究結果顯示第78周時Aducanumab高劑量組可達到認知功能、功能獨立性、神經精神多個維度的臨床終點(見圖6、7),β澱粉樣蛋白PET檢測顯示Aducanumab高劑量組的β澱粉樣蛋白相比基線降低達71%(見圖8),這證實了Aducanumab的劑量依賴性靶向的結合作用。EMERGE和PRIME研究均表明Aβ減少幅度與減緩臨床惡化呈強相關(見圖9)。
注:縱座標表示β澱粉樣蛋白PET檢測顯示Aducanumab組較基線改變的校正均值
EMERGE研究中的CSF生物標誌物檢測顯示,Aducanumab治療78周,較基線水平,低劑量和高劑量組的Aβ1-42水平增加,p-tau和t-tau水平降低,高劑量組尤為明顯(見圖10),提示Aducanumab治療全面改善了AD腦脊液A/T/N生物標誌物水平。
儘管ENGAGE研究未達到主要和次要臨床終點,但PET下仍觀察到治療組患者的腦內澱粉樣蛋白呈劑量依賴性下降(見圖11)。造成兩個Ⅲ期結果不完全一致的原因,與ENGAGE高劑量組10 mg/kg給藥的總體暴露量較低(由研究方案修改引起),以及快速進展型阿爾茨海默病患者的數量和分佈不均有關。
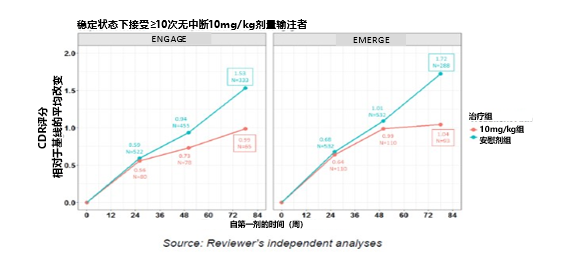
另外,在ENGAGE研究亞組分析中顯示,穩定狀態下接受≥10次無中斷10mg/kg劑量輸注的患者,CDR-SB下降速度慢於安慰劑組,這與EMERGE研究的結果保持一致(見圖12),提示Aducanumab輸注延緩了患者的疾病進展。
4. ENGAGE和EMERGE研究的安全性結果
ENGAGE和EMERGE研究期間,Aducanumab治療組的AREA-E發生率較安慰劑有所增高,但大部分患者 (Aducanumab10 mg/kg組74%) ARIA-E無症狀。最常見的ARIA-E症狀為頭痛、意識模糊、頭暈和噁心,大多數症狀的臨床嚴重程度為輕度(67.7%)或中度(28.3%),且98%在研究過程中得以緩解(見圖13)。
Aducanumab治療長期健康結局結果
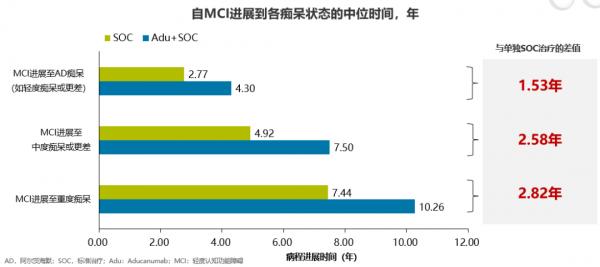
根據模型預測的Aducanumab治療長期健康結局最新結果顯示,相較於單獨標準治療,加用Aducanumab治療不僅可能減少AD進展至更嚴重階段或住院的患者比例(見圖14),還可能延緩MCI患者痴呆的病程進展(見圖15)。
總結
➤ Aβ聚集導致的澱粉樣斑塊是AD形成和發展的關鍵因素。
➤ Aducanumab是目前FDA批准的全球首個且唯一,針對AD明確病理機制的人IgG1抗Aβ單克隆抗體。
➤PRIME研究顯示:Aducanumab能夠降低AD前驅期和輕度AD患者的澱粉樣蛋白,延緩認知功能下降,延長48個月資料進一步證實其長期穩定有效性。
➤ENGAGE和EMERGE研究顯示:Aducanumab可有效減緩AD源性MCI和輕度AD患者在認知功能、功能獨立性和神經精神多個維度的臨床惡化,降低斑塊負荷,且耐受性好。
➤根據模型預測的Aducanumab治療長期健康結局結果顯示:Aducanumab可能延緩MCI患者痴呆病程進展,最長可至 2.82年。