測定空氣裡氧氣含量的實驗,是初中化學階段的重要實驗,也是很多實驗試題的原型。該實驗的操作難度較大,要想獲得成功,有很多問題需要注意。
首先我們來了解一下實驗原理:
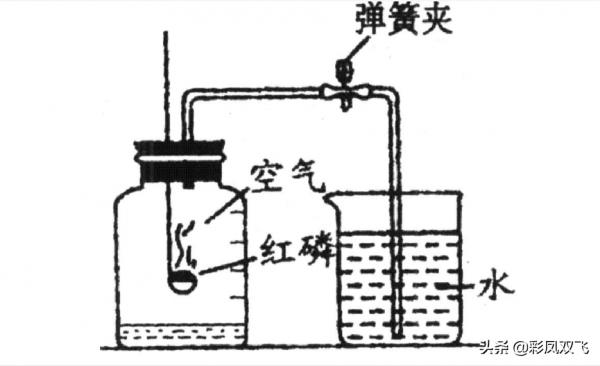
實驗中,紅磷燃燒消耗了裝置內的氧氣,使裝置內氣體減少,壓強降低。所以開啟止水夾,水會流進集氣瓶中。消耗了多少氧氣,就會流進來多少體積的水。所以,流進來水的體積,大約就是集氣瓶中氧氣的體積。
本實驗操作中一定要注意到一些問題,實驗才能成功,正所謂細節決定成敗。
第一,裝置的氣密性一定要良好。實驗時,紅磷點燃後要立刻伸進集氣瓶中並迅速塞進瓶塞,實驗要密在閉的容器中進行。倘若裝置氣密性不好,那麼紅磷燃燒時,裝置內的氣體受熱體積膨脹,可能會有一部分散逸出去;而燃燒熄滅後,外面的空氣也有可能會流進來補充。那麼或者造成裝置內壓強不發生明顯變化,水流進來很少或不會流進來。或者因紅磷燃燒時散失的氣體較多,使最終流進來的水大於五分之一。
第二,紅磷必須要過量。紅磷燃燒消耗氧氣,若紅磷的量不足,不能充分消耗裝置內的氧氣,那麼開啟彈簧夾後,流進來的水會比較少,測得的氧氣的含量會偏小。
第三,一定要等到裝置冷卻(溫度恢復到原來的溫度)後再開啟彈簧夾。紅磷燃燒放出熱量,裝置內氣體受熱體積膨脹。雖然氧氣被消耗,但在較高的溫度下,剩餘氣體體積膨脹的情況下,裝置內壓強不會明顯小於外界氣壓,甚至有可能大於外界氣壓。這時候開啟彈簧夾,可能流進來的水會偏少,或者水根本不會流進來,甚至有可能裝置內的氣體會往外流,導管口會有氣泡冒出。這樣是無法測定空氣裡氧氣的含量的。
當然,即使這些問題都注意到了,實驗仍然是會有誤差的。因為當空氣中氧氣的含量低到一定的程度後,就不能再支援燃燒了。所以就算用了過量的紅磷,也不能保證氧氣被完全消耗。所以該實驗測定的氧氣的含量會比空氣中氧氣的實際含量稍微偏小一點。
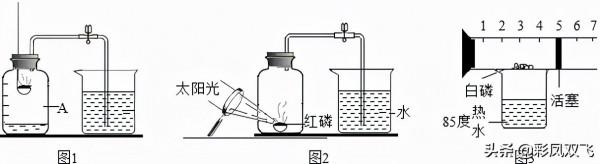
另外,還有一點需要注意,那就是不能用硫、木炭等燃燒後生成氣體的物質代替紅磷。例如木炭,燃燒時消耗了裝置內的氧氣,但同時生成二氧化碳氣體來補充。實驗結束後裝置內壓強不會有明顯的變化,實驗不能成功。而紅磷燃燒後生成的五氧化二磷是固體,體積很小,幾乎不能影響裝置內壓強的變化。所以本實驗一般用紅磷或者白磷,而不能用燃燒後生成氣體的物質。
(圖片來自網路)