T細胞在疫苗免疫和腫瘤免疫治療方面都有至關重要的作用。然而不管是疫苗開發還是腫瘤免疫治療,目前都還存在諸多不足,所以理清T細胞的免疫記憶和二次免疫應答的分子機制,對於後續開發更高保護水平的疫苗和更完善的腫瘤免疫療法是至關重要的。
2022年2月21日,美國哈肯薩克大學醫學中心 (Hackensack University Medical Center) 薛海暉教授團隊和弗吉尼亞大學 (University of Virginia) 臧充之教授團隊合作在Nature Immunology上發表了題為Tcf1 preprograms the mobilization of glycolysis in central memory CD8+ T cells during recall responses的研究論文。清晰闡述了轉錄因子Tcf1預程式設計了CD8+TCM細胞中糖酵解的調動,以滿足與二次應答CD8+ T 細胞快速增殖相關的能量需求。
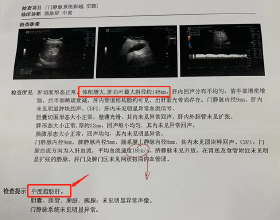
論文截圖
TCM細胞發揮作用依賴於轉錄因子Tcf1
TCM細胞(CD8+ central memory T cells)是CD8+記憶T細胞的一個亞群,由CD8+T細胞分化而來。CD8+TCM細胞在淋巴器官中較為豐富,在二次刺激時具有極強的增殖能力。Tcf1(transcription factor T cell factor 1,由基因Tcf7編碼)在T細胞中大量表達,其在T細胞中的調節作用是機體產生記憶T細胞和免疫記憶的基礎。
在該研究中,科研團隊首先明確了TCM細胞二次免疫對Tcf1的依賴性。研究人員透過比較Tcf7基因敲除小鼠與野生型小鼠TCM細胞二次應答情況,發現Tcf7基因缺失小鼠的二次應答TCM細胞顯著少於野生型小鼠,而且無法有效清除病原體。


Tcf7基因缺失小鼠的二次應答TCM細胞顯著少於野生型小鼠,而且無法有效清除病原體 | 參考文獻[1]
此外,研究團隊透過比較Tcf7基因敲除小鼠與野生型小鼠發生二次免疫後的轉錄組資料,找到了623個“Tcf1-dependent, recall-induced genes”,即在野生型小鼠的二次免疫中正常誘導,而在基因敲除小鼠中誘導異常的基因。經過註釋,發現大部分基因與細胞週期、DNA複製和核糖體蛋白/蛋白質翻譯有關,這和二次應答中CD8+細胞的快速增殖相對應;而另外一部分基因與線粒體、氧化磷酸化以及糖酵解相關,這與二次免疫應答需要大量能量相一致。

大部分基因與細胞週期、DNA複製和核糖體蛋白/蛋白質翻譯有關,另外一部分基因與線粒體、氧化磷酸化以及糖酵解相關 | 參考文獻[1]
更進一步,研究人員藉助CHIP-seq技術,對染色質中與Tcf1結合位點進行測序分析後發現:靜息狀態下,Tcf1大都與CD8+TCM細胞中的關鍵基因位點結合。由此推測,Tcf1在二次刺激時預先確定了這些關鍵基因的轉錄啟用。
創新思路和高標技術
為了更深層次理解Tcf1在CD8+TCM細胞二次應答中的調控機制,研究團隊設計和使用了一系列高標準的實驗技術。首先,科研人員透過ATAC-seq來分析Tcf1缺失對染色質可及性的影響。分析發現,與野生型相比,在基因敲除組中由刺激導致的染色體可及性變化更小,具體表現為刺激狀態下,Tcf1缺失導致染色質開放程度更低。
刺激狀態下,Tcf1缺失導致染色質開放程度更低 | 參考文獻[1]
結合轉錄組資料,研究人員發現這種改變與轉錄組的關係密切,具體表現為:野生型中優勢的chrAcc(chromatin accessibility)位點可以在靜息狀態的CD8+TCM細胞中起到穩定增強子的作用,而那些與Tcf1共同富集的chrAcc位點則可以促進CD8+TCM細胞在二次應答中關鍵靶基因的協同啟用。
根據之前的研究,Tcf1在初始CD8+T細胞可以調控三維基因組,所以研究人員透過Hi-C技術(High-through chromosome conformation capture)獲取了染色質三維結構資訊,並與前面發現的chrAcc位點進行關聯分析。結果表明,Tcf1介導的染色質互作提供了一個有序的結構環境,使穩定的增強子在空間上接近靜息狀態TCM細胞中的靶基因,從而促進這些元件及其相關靶基因在二次應答時的啟用,即預程式設計了相關基因的表達。
為了確定這種預程式設計基因的方式對於二次應答功能的重要性,研究人員首先經過GSEA(gene set enrichment analysis)分析發現,糖酵解相關基因是其中富集最多的基因之一。結合轉錄組以及chrAcc位點的分析發現,這些糖酵解相關基因在靜息狀態野生型和Tcf1缺陷 CD8+TCM細胞中沒有差異表達,但與野生型CD8+TCM細胞相比,在受刺激的Tcf1缺陷細胞中顯示出誘導表達異常和染色質開放程度降低,這表明Tcf1在二次應答的CD8+TCM細胞中預程式設計了糖酵解基因的誘導表達。
接下來,研究人員設計了一項實驗來觀察是否有Tcf1缺陷對CD8+TCM細胞糖酵解的影響,透過對感染細胞進行ECAR(Seahorse Extracellular Flux Analyzer to track extracellular acidification rate)和OCR(oxygen consumption rate)分析來獲取糖酵解的資料,結果發現,相比於野生型,Tcf1缺陷 CD8+TCM細胞糖酵解能力減弱。
研究團隊還透過基因克隆和轉基因等技術,驗證了Tcf1缺陷型CD8+TCM二次應答異常可以由Tcf1預程式設計基因透過異位表達進行恢復。實驗觀察表明,Tcf1預程式設計基因的異位表達在Tcf1充足和Tcf1缺乏的CD8+TCM細胞中加強了免疫記憶,其中部分是透過增強糖酵解的啟用來實現的。

Tcf1缺陷型CD8+TCM二次應答異常可以由Tcf1預程式設計基因透過異位表達進行恢復 | 參考文獻[1]
在這項研究中,研究人員發現了一個全新的二次免疫調控機制:依賴於 Tcf1的染色質相互作用可以拉近增強子與下游基因啟動子的空間距離,透過“預程式設計”,提前進入“準備就緒”狀態。相關研究還發現,Tcf1對組蛋白去乙醯化酶(HDAC)抑制劑較為敏感,所以這項成果對Tcf1在二次免疫中作用機制的解析必然會對轉化醫學產生積極影響,並可能使治療干預措施能夠增強抗菌和抗腫瘤免疫。
參考文獻
Shan, Q., Hu, S.S., Zhu, S. et al. Tcf1 preprograms the mobilization of glycolysis in central memory CD8+ T cells during recall responses. Nat Immunol 23, 386–398 (2022). https://doi.org/10.1038/s41590-022-01131-3
作者:邊城
編輯:酥魚
排版:尹寧流
題圖來源:《工作細胞》
論文資訊
釋出期刊《自然·免疫學》 Nature Immunology
釋出時間2022年2月21日
論文標題
Tcf1 preprograms the mobilization of glycolysis in central memory CD8+ T cells during recall responses
(DOI:https://doi.org/10.1038/s41590-022-01131-3)
歡迎關注果殼硬科技