編者按:原發性先天性青光眼是一種嚴重的漸進性神經退行性致盲性疾病,也是60歲以上人群失明的最常見原因之一,其特徵表現為TM和Schlemm's管(SC)的發育缺陷以及房水流出通道受阻。有研究證實ANGPT1和SVEP1基因變異可被確定為原發性開角型角青光眼(POAG)的等位風險基因。ANGPT1-TEK訊號通路在小鼠SC發育中發揮著重要作用,也是維持成年小鼠和非人類靈長類動物IOP平衡的重要調節劑,因此,抑制ANGPT-TEK訊號可導致IOP迅速升高並誘發青光眼。此外,SC和TM的調節通路或許可作為調節房水流出並降低IOP的治療目標,TM中表達的SVEP1基因對淋巴的發育至關重要,也與PCG以及TEK功能變異的異質性缺失具有相關性。近期發表於Nature Communications雜誌上的一項研究帶來了一個好訊息,該研究在小鼠模型中發現了一種可有效促進房水流出的有效靶向療法,這種新方法有望扭轉青光眼患者潛在的解剖學缺陷。
循循漸進:青光眼的探索性研究
高眼壓是導致青光眼疾病進展的一項主要危險因素,目前青光眼治療的主要手段是降眼壓治療。降眼壓眼藥水和鐳射治療均可有效降低IOP並延緩疾病進展,但並不能完全治癒青光眼,原發性先天性青光眼則只能選擇手術治療。多數患者常需要兩種或兩種以上藥物聯合治療,且藥物治療也有個體差異性。因此,探索青光眼的有效治療方案迫在眉睫。
研究一:Angpt1的表達
對實驗小鼠進行ANGPT1注射治療後收集研究資料並進行分析。研究發現,Angpt1+NC模型中虹膜Angpt1表達幾乎為零,視網膜中Angpt1表達輕度減少;除視網膜內界膜外,Angpt1可在神經上皮無長突細胞中表達。儘管對TEEK和ANGPT2訊號的依賴性很強,野生型小鼠視網膜中Angpt1表達極低,但1型視網膜血管生成並不需要Angpt1。
圖1. A未檢測到Angpt1表達;B重組僅限於視網膜內膜;C特定敲除(Angpt1+NC)小鼠;D 12 周Angpt1 +NC小鼠Angpt1mRNA表達顯著減少。視網膜中觀察到Angpt1mRNA表達有所減少,而肺等實體器官Angpt1表達方式無改變。
研究二:驗證Angpt1+NC小鼠是否存在青光眼跡象
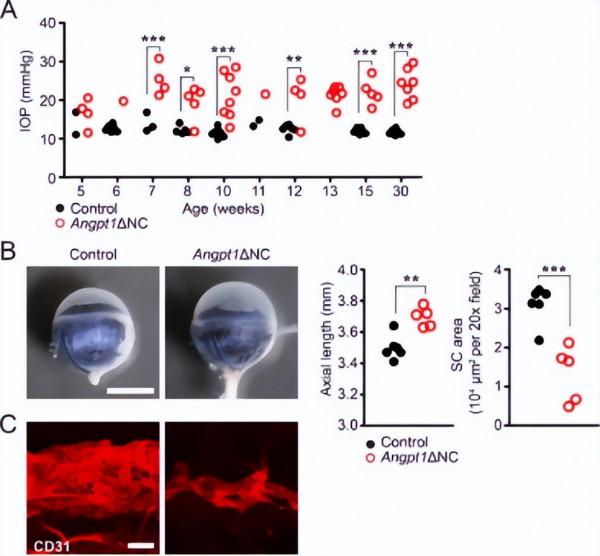
研究結果顯示,7 周大Angpt1+NC小鼠模型中IOP升高且眼軸變長,15周大時SC區域大幅減少。因此,TM 細胞ANGPT1的分泌對SC形成和維持IOP 平衡至關重要。
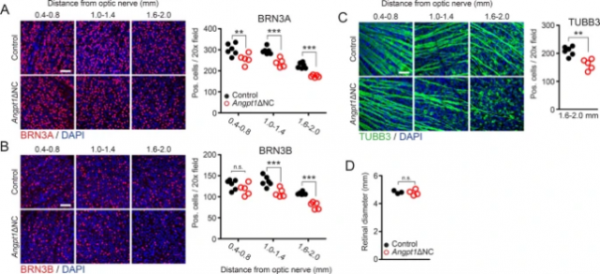
圖3. 15周大Angpt1+NC小鼠視網膜(A)BRN3A和(B)BRN3B陽性RGCs細胞核的數量減少。這種減少在外周視網膜中尤為明顯。C Angpt1+NC小鼠中觀察到RGCs減少。D 15周內Angpt1+NC小鼠視網膜直徑基本保持不變。
研究三:Angpt1+NC小鼠的青光眼表型
研究證實,高眼壓型青光眼的視力喪失與視網膜神經節細胞(RGCs)凋亡有關。該研究對RGC進行了計數統計後發現,5天時RGC數量無明顯變化,15周時Angpt1+NC小鼠RGC顯著減少,且在外周視網膜中表現尤為明顯。研究中還對視網膜血管進行了檢測以確認Angpt1+NC小鼠RGC的減少是否由IOP升高所致而與視網膜缺血無關。
圖3. 15周大Angpt1+NC小鼠視網膜(A)BRN3A和(B)BRN3B陽性RGCs細胞核的數量減少。這種減少在外周視網膜中尤為明顯。C Angpt1+NC小鼠中觀察到RGCs減少。D 15周內Angpt1+NC小鼠視網膜直徑基本保持不變。
研究四:一種與PCG相關的新基因-Svep1
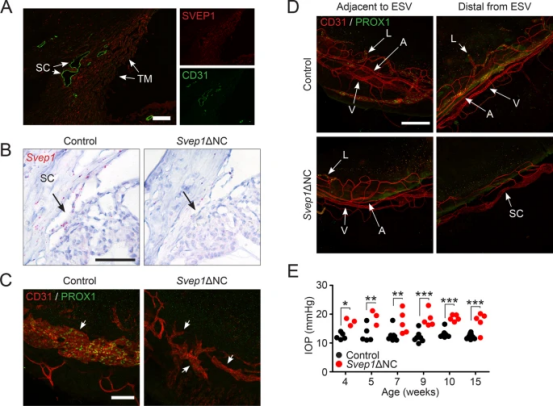
最新觀點稱SC可被認為是一種獨特的"混合"內皮。SC同時具有血管和淋巴管特性,且淋巴訊號分子(如PROX1和FLT4)在SC調節中具有重要作用。SVEP1或可出現導致編碼淋巴管發育和瓣膜形成所需的細胞外基質蛋白相關的功能缺失的基因變異,並推測該突變可作為改善PCG的“修飾劑”。GWAS已確定SVEP1變異是POAG 的等位風險基因,進一步支援了SVEP1在平衡IOP中的調節作用。假設SVEP1訊號通路是TM-SC的一種聯絡通路,且在TM和SC內皮中SVEP1表達豐富(圖4A)。成功建立小鼠模型後發現,隨著生長可表現出嚴重低形態SC缺乏PROX1表達(圖4B、4C)以及四肢血管雜亂無章(圖4D),在眼淋巴血管中僅觀察到部分保留的區域。4周開始,實驗小鼠出現IOP升高趨勢,因此研究確定了SVEP1對IOP平衡的重要性。
圖4. A人角膜免疫染色,在TM和SC內皮中觀察到SVEP1表達。B Svep1+NC小鼠Svep1表達損失透過原位雜交得到確認。產後第10天Svep1+NC模型,一個畸形的SC的形成沒有明顯的PROX1。D除SC形成缺陷外,Svep1+NC小鼠中還發現了四肢血管和淋巴網缺陷,其在Svep1突變體中雜亂無章。確認這種畸形SC和雜亂的畸形外流通路提供了不足的排水功能, 4周大開始,眼壓升高。
研究五:神經峰-SC的細胞基礎
該研究對所建立的小鼠模型,進行分析細胞學分析後發現,在Angpt1+NC模型中檢測到的Angpt1表達細胞很少,且在虹膜角/邊緣區域的Angpt1表達細胞來自神經波峰。此外,該研究還進行了SC內皮細胞的識別、叢集分類、TM細胞群的識別等。
研究六:相關基因和通路的表達
該研究在SC內皮細胞中發現了21個基因,在假定TM細胞群中發現了30個基因。在SC或TM中檢測到的一些具有已知表達的基因在兩個細胞群中都超過了閾值,且它們的表達出現嚴重偏斜。
新觀點:Hepta-ANGPT1或可作為青光眼治療的潛在有效目標
ANGPT-TEK訊號通路可增強SC功能並促進房水流出。最近研發的一種高效ANGPT1-mimetic融合蛋白,可在體內和體外有力地啟用TEEK。對小鼠模型研究發現,注射融合蛋白後SC區域急劇增加,PROX1表達水平升高,血管形態依然正常,這表明其作用特定侷限於SC。重複Angpt1+NC小鼠實驗後發現,模型中出現低形態SC,其PROX1染色減少或缺失,因此判斷Angpt1-mimetic在Angpt1+NC小鼠中誘導的內皮結構並非完全成熟的SC。為了確定在停止Hepta-ANGPT1 治療後是否對成年小鼠的房水流出通路具有持久影響,該研究建立相關動物模型並分析資料後發現,停止治療後實驗小鼠IOP降低。因此,研究推測Hepta-ANGPT1 治療具有持久效果。
雖然之前有研究描述過TM和SC中ANGPT1的表達,但均依賴於全身刪除或阻斷抗體,而不是組織特定性刪除,因此ANGPT1的細胞起源未經驗證。該研究中利用經神經波峰特異性刪除Angpt1,以確認SC調節ANGPT1的TM起源。該研究提出可將TEK 啟用作為治療策略。對SC分子特性、發育和功能的更深入瞭解,有利於為研究人員針對SC和常規房水流出通路或內皮特定訊號通路研發提供新思路,這些藥物將直接透過廣泛活性化合物(如Rho激酶抑制劑、作用素去聚合劑等藥物)發揮作用。現階段,透過 ANGPT-TEK 通路達到治療效果是較為先進的一項研究。
最近的一項藥理動力學研究表明,在靜脈注射Hepta-ANGPT1 3天后,兔房水中Hepta-ANGPT1水平很高,該研究資料與之前的研究資料具有一致性。Hepta-ANGPT1治療期間或注射後,不會誘發SC或其他部位病理性血管的生成。此外,該研究種結果還表明,ANGPT1和SVEP1是TM 的衍生分子,也是SC的基本調節器,其中ANGPT1可誘導SC發育和生長。這些訊號分子或可成為青光眼的新型療法。資料還顯示其他幾個訊號分子也與青光眼有關,不久的未來也可為針對房水流出途徑的研究和藥物開發提供極大的可能性。
小結
有小鼠模型顯示敲除Angpt1或Svep1可出現類青光眼表現。大量研究已證實TM的表達是SC的基本驅動力。現已成功利用基因編輯建立類原發性先天性青光眼的小鼠模型,並探索出透過一種新型、持久、無毒的蛋白質治療(Hepta-ANGPT1),或可作為預防青光眼的形成並降低IOP的有效手段。Susan Quaggin教授指出,未來可進一步研發適宜的蛋白質輸送系統並將其投產。此外,科學家還利用生物資訊學和單細胞RNA序列資料來理解和識別青光眼途徑,這些途徑可在未來進一步探索以達到實現疾病治療的目標。促進改善存在SC生長缺陷的治療是實現青光眼治癒的第一步,該研究探索性識別出不同TM和SC細胞群,確定了TM-SC訊號通路,證實了血管生成素訊號對SC的重要性。此外,該研究突出了 ANGPT1-TEK訊號和 TM-SC 訊號在平衡IOP中的核心作用,併為青光眼治療提供了新的靶向候選目標。
(來源:《國際眼科時訊》編輯部)
SC 訊號在平衡IOP中的核心作用,併為青光眼治療提供了新的靶向候選目標。
(來源:《國際眼科時訊》編輯部)