寶寶一出生(甚至還沒出生,越來越卷),家長們就會開始關注孩子的身高、體重等指標是否達到了同齡人標準,隨著孩子長大,這些指標的參考範圍也會隨之變化。
那這參考範圍是從何而來的呢?這主要靠大規模人群調查,將95%某一年齡的兒童身高、體重所在的區間(或均值±2個標準差)定義為參考範圍。
另一個家長們很關心的方面——孩子的大腦發育情況,目前還沒有量化的指標,只能透過智商測試、考試分數等間接反映。1歲的孩子大腦是怎樣的呢?10歲的孩子大腦又該是怎樣的呢?恐怕目前還沒有參考範圍能去量化這一問題。
近日,由劍橋大學的R. A. I. Bethlehem教授和賓夕法尼亞大學的J. Seidlitz教授領銜的國際團隊,在頂級期刊《自然》上發表了一項重磅研究成果,有望解決上述問題。
他們對101457名不同年齡層次人群(從受孕後115天到100歲)的123984次MRI資料進行分析,定義了大腦與年齡相關的變化特徵,繪製了世界上首個涵蓋整個年齡段的人腦發育圖譜,識別出了多個此前未被報道過的腦生長髮育關鍵時期,並且發現多種疾病患者(如阿爾茨海默病與精神疾病)的腦結構與正常人群存在不同[1]。
據瞭解,這是迄今最大規模的神經影像學研究,為神經科學研究提供了重要的參考資源。
與身高或體重等容易得到的引數相比,量化大腦特徵的引數提取難度非常之大,這使得我們很難說某個人的大腦形態是否處於該年齡水平的正常範圍。
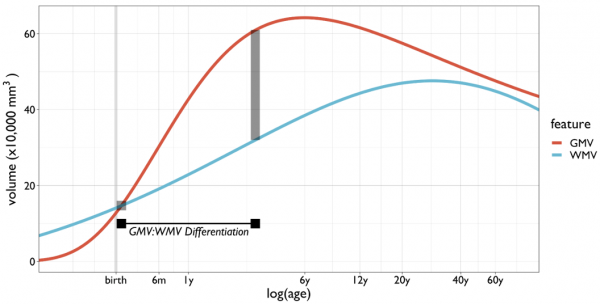
為了更全面、普遍地量化整個人類生命週期內的大腦特徵,R. A. I. Bethlehem教授和的J. Seidlitz教授透過對正常人群的腦部MRI資料進行解析,使用廣義相加模型(GAMLSS)模擬大腦特徵隨時間變化的非線性軌跡[2],描繪了4個大腦指標的時間變化曲線:皮質區灰質總體積(GMV)、白質總體積(WMV)、皮質下灰質總體積(sGMV)和腦室或腦脊液總體積(VV)。

皮質區灰質總體積(GMV)、白質總體積(WMV)、皮質下灰質總體積(sGMV)和腦室或腦脊液總體積(VV)隨年齡變化軌跡
從上圖我們可以看出,皮質區灰質總體積從孕中期開始快速增長,在5.9歲時體積達到峰值,隨後近乎線性下降。白質總體積從孕中期到兒童早期迅速增加,在28.7歲時達到峰值,隨後在50歲後加速下降。這表明幼兒期是人腦發育的關鍵時期。
與皮質區灰質總體積和白質總體積相比,皮質下灰質總體積在青春期達到峰值。相比之下,腦室或腦脊液總體積在2歲之前呈上升趨勢,直到30歲之前都處於平臺期,然後緩慢增長,並在60歲左右開始變為指數級增長。很明顯,這一指數級增長是由於自然性的腦萎縮造成的。
隨著年齡的變化,個體差異程度也隨之改變。皮質區灰質總體積變異程度在早期發育階段不斷增加,在4歲時達到峰值,而皮質下灰質總體積變異程度則在青春期後期達到峰值。白質總體積變異程度在40歲左右達到頂峰,而腦室或腦脊液總體積在人類壽命的末期變異程度最大。這意味著人腦變化的差異貫穿整個年齡段。
接著研究人員還擴充套件分析了其他從MRI中可提取的大腦圖譜資訊,如大腦總體積(TCV)、總表面積(TSA)、平均皮質厚度(MCT)以及34個皮質功能區體積的時間變化軌跡。
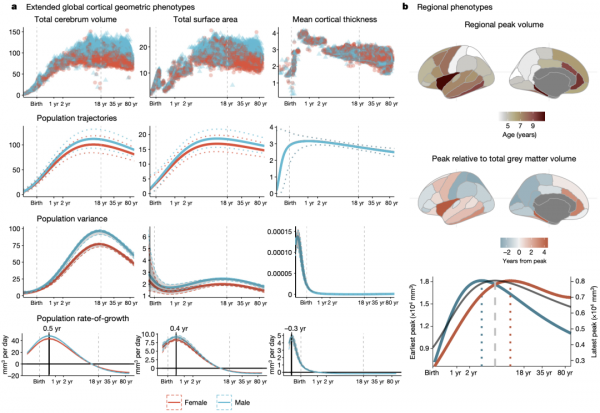
大腦總體積(TCV)、總表面積(TSA)、平均皮質厚度(MCT)以及皮質功能區體積的時間變化軌跡
不出所料,總表面積與大腦總體積在整個時間尺度上的軌跡較為一致,達峰時間約在11-12歲(總表面積,10.97歲;大腦總體積,12.5歲)。相比兩者,平均皮質厚度明顯更早的達到了峰值(1.7歲),這與先前報道的結果相一致,即皮質厚度在圍產期增加,在發育後期開始逐漸下降[3, 4]。這些都是傳統意義上反應腦容量的指標,同樣表明大腦在人類早期可塑性更強,學習的潛力也更大。
而對於皮質功能區體積,34個皮質功能區灰質體積達峰的年齡差異很大(從大約2歲到10歲不等),其中初級感覺區(包括視覺區、聽覺區和機體感覺區)最早達到峰值,在達峰後下降較快,而額顳聯合區(整合資訊,與高階認知功能有關)達峰值較晚,達峰後下降較慢。這一現象也與人的發育需求所一致。
從以上結果可以看出,大腦各組織在不同時期軌跡有明顯差異,研究人員試圖找出大腦各組織發育軌跡的關鍵節點。
為此,他們將大腦各組織時間軌跡的達峰節點(體積達到最大處)和發育速度峰值節點(軌跡上升階段的斜率最大值處)定義為發育的里程碑。
將各組織時間軌跡整合在一起後可以看出,只有皮質區灰質總體積和平均皮質厚度在青春期開始前達到峰值,大腦總體積和總表面積則在青春期開始前後達到峰值,皮質下灰質總體積在青春期中期達到峰值,白質總體積在成年早期才達到峰值。
皮質區灰質總體積(5.08月)、皮質下灰質總體積(5.65月)和白質總體積(2.4歲)的發育速度在嬰兒期和兒童早期達到最大,而大腦總體積則在皮質區灰質總體積和白質總體積之間速度達到峰值,平均皮質厚度的峰值速度出現在出生以前(-0.38歲),大約相當於妊娠中期。
據瞭解,這也是首次發現平均皮質厚度在出生前存在發育速度峰值。這些表明大腦發育最快的時候基本出現在出生前後,所以越來越卷的胎教似乎也有一定的道理。
研究人員還識別出皮質區灰質總體積:白質總體積分化的時間節點。約出生後1個月開始,大腦中灰質的體積超過白質(皮質區灰質總體積和白質總體積曲線相交),此後灰質與白質的體積差不斷擴大,並在3歲左右達到峰值。皮質區灰質總體積:白質總體積分化的這一特徵,可能反映了大腦髓鞘形成和神經元突觸增長的潛在變化。
就像身高和體重一樣,有了以上的資料,就可以繪製大腦特徵的年齡匹配的參考範圍。
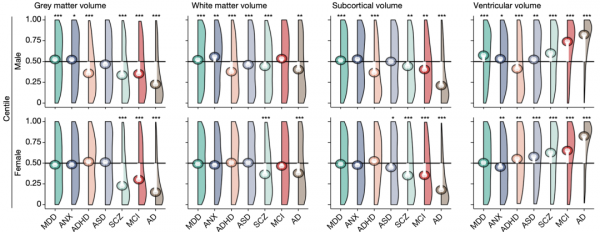
研究人員還收集了一些疾病患者(如阿爾茨海默病等)的MRI資料,提取其大腦特徵,與相同性別、年齡的人群進行比較,發現與正常人群相比,疾病組的腦特徵具有明顯差異。
阿爾茨海默病患者的差異最明顯,女性患者的皮質區灰質總體積中位數在正常人群的百分點陣圖上處在14%的位置,與正常人群皮質區灰質總體積中位數相差36個百分點。這表明阿爾茨海默病患者幾乎大腦各組分的體積都小於正常人群,尤其是對於人智力影響更為關鍵的灰質體積。
在使用百分位數馬氏距離(CMD)來衡量疾病患者與正常人群腦部特徵的差異後,研究人員發現,與正常人群差異最大的三種患病人群依次為阿爾茨海默病(AD)、輕度認知障礙(MCI)和精神分裂症(SCZ)。
智力障礙相關疾病患者(主要指AD和MCI)與對照人群差異最大出現在成年後期,而青春期則是精神障礙相關疾病患者與對照人群差異最大的時期。這些結果與各疾病發病年齡相符,AD和MCI多見於中老年人,而精神障礙相關疾病常起病於青春期。

百分位數馬氏距離(CMD)來衡量疾病患者與正常人群腦部特徵的差異
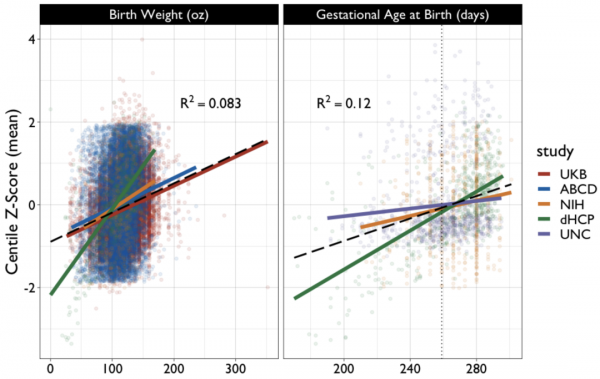
更有意思的發現是,出生時的胎齡和體重將影響今後腦組織的發育,胎齡(P < 2 × 10−16)和出生體重(P < 2 × 10−16)越大,則今後腦組織體積所處百分位數位置越高。
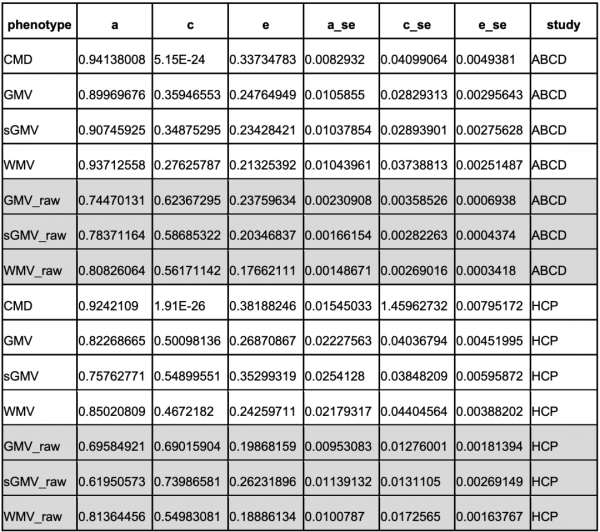
此外,在雙胞胎人群中,可以發現遺傳對大腦發育具有相當大的作用。在兩項納入雙胞胎的研究中(總共913對雙胞胎),透過Cholesky分解法估算遺傳因素的影響,將影響人群大腦差異的因素劃分為3部分,累加遺傳(A)、共同環境(C)和獨特環境(E),結果發現遺傳因素是這3個因素中對人群影響最大的那一個。
最後,研究人員開發了一個互動式網站(http://www.brainchart.io),感興趣的朋友可以上傳超過100例樣本的MRI資料集(為了能評估外部資料集所帶來的偏倚,暫不支援單個樣本及小樣本MRI資料集),即可估算新樣本中每個人在所處年齡段的大腦特徵百分位數位置,手裡有資料的小夥伴可以去試一試哦。

外部資料集可上傳至http://www.brainchart.io,獲取新樣本中每個人在所處年齡段的大腦特徵百分位數位置
總的來說,該研究構建的腦發育圖譜,不僅可以用來作為監測兒童大腦發育的輔助工具,還可能為一些疾病的診斷帶來幫助(如AD等),同時開發了線上工具,方便了更多資料來對此內容進行豐富與擴充套件,相信在將來,腦圖譜或許將會和身高、體重一樣,成為人們日常所關注的指標之一。
不過,需要指出的是,即使是身高、體重和BMI等已廣泛運用於臨床的指標,它們在臨床使用中(如兒童個體發育監測)也需要結合實際情況進行分析。因此,該腦圖譜離真正運用於臨床還有一段距離(目前僅用於科研),接下來還需要進行大量的研究,來驗證腦圖譜在發育監測和疾病診斷中的效果。但毫無疑問,這在大資料時代絕對代表了數字化診斷的未來發展方向。
1.Bethlehem RAI, Seidlitz J, White SR, Vogel JW, Anderson KM, Adamson C, Adler S, Alexopoulos GS, Anagnostou E, Areces-Gonzalez A et al: Brain charts for the human lifespan. Nature 2022.
2.Borghi E, de Onis M, Garza C, Van den Broeck J, Frongillo EA, Grummer-Strawn L, Van Buuren S, Pan H, Molinari L, Martorell R et al: Construction of the World Health Organization child growth standards: selection of methods for attained growth curves. Stat Med 2006, 25(2):247-265.
3.Vasung L, Zhao C, Barkovich M, Rollins CK, Zhang J, Lepage C, Corcoran T, Velasco-Annis C, Yun HJ, Im K et al: Association between Quantitative MR Markers of Cortical Evolving Organization and Gene Expression during Human Prenatal Brain Development. Cereb Cortex 2021, 31(8):3610-3621.
4.Fjell AM, Grydeland H, Krogsrud SK, Amlien I, Rohani DA, Ferschmann L, Storsve AB, Tamnes CK, Sala-Llonch R, Due-Tonnessen P et al: Development and aging of cortical thickness correspond to genetic organization patterns. Proc Natl Acad Sci U S A 2015, 112(50):15462-15467.