王延鵬 ,宋超,管玉瑤 ,鄭磊 ,楊靜,蘇茂玲
目的:探討國內眼用製劑臨床試驗研究現狀和發展趨勢,為我國眼用製劑的研發提供參考資訊。
方法:檢索收集藥物臨床試驗登記與資訊公示平臺登記的所有眼用製劑專案資訊,採用文獻計量學方法,統計臨床試驗專案登記的劑型與數量、申辦者、研究分期、適應證、創新藥研發現狀、臨床試驗藥物上市情況、國際多中心臨床試驗等資訊,分析國內眼用製劑臨床試驗的特點。
結果:(1)平臺共登記了 73 項臨床試驗;(2)藥物劑型以注射劑及滴眼劑為主;(3)適應證以黃斑水腫、黃斑變性等眼底病變為主;(4)創新藥物共有 12 種(2 種為化學藥物創新藥、10 種為生物製品創新藥),8 種生物製品透過抗 VEGF 治療眼底病變;(5)承擔專案數量前三位的申辦者中,2 個為國內企業,1 個為外資企業;(6)除創新藥物外,其餘 24 種臨床試驗相關藥物中,有 7 種藥物已完成試驗並於國內上市;(7)國際多中心試驗共 14 項,其中由國內企業申辦的僅 2 項。
結論:我國眼用製劑的專案數量逐年穩步增長,其中治療眼底疾病的生物製品為研發熱點;國內企業申報專案數量較多,但國內企業發起的國際多中心試驗仍需提升。
關鍵詞
眼用製劑;藥物臨床試驗;現狀分析
|
_ |
正文 |
_ |
眼睛是人最重要的感知器官,隨著我國老齡化程序的不斷髮展,眼用製劑新品種的開發與應用需求日益突出。眼部組織結構複雜且特殊,存在較多屏障,更加有效的治療藥物及更加適宜的藥物遞送系統仍需要不斷開發與應用【1-2】。眼用製劑是指直接用於眼部發揮治療作用的無菌製劑【3】。本研究基於藥物臨床試驗登記與資訊公示平臺,對國內眼用製劑的臨床試驗開展情況進行總結分析,探討國內眼用製劑臨床試驗研究現狀和發展趨勢,為我國眼用製劑的研發提供資訊參考。
內容由凡默谷小編查閱文獻選取,排版與編輯為原創。如轉載,請尊重勞動成果,註明來源於凡默谷公眾號。
1
資料與方法
1.1 研究物件
在國家藥品監督管理局藥品評審中心藥物臨床試驗登記與資訊公示 平 臺(http://www.chinadrugtrials.org.cn/index.html)(以下均簡稱為“平臺”)登記的所有眼用製劑的臨床試驗專案。時間起始於 2013 年,截至 2020 年 12 月 31 日。
1.2 研究方法
採用以下檢索策略檢索:平臺高階搜尋中藥物名稱搜尋“眼”;平臺首頁搜尋框分別搜尋:黃斑,角膜,視網膜,玻璃體,眼表,青光眼,白內障,乾眼、近視,遠視,弱視,散光,雪盲,斜視。彙總並收集每項臨床試驗專案以下資訊:登記號、試驗狀態、藥物名稱、適應證、試驗專業題目、藥物型別、試驗分類、試驗分期、試驗範圍(國內試驗、國際多中心試驗)、入排標準、重點指標、申辦者資訊等;透過國家藥品監督管理局藥品審評中心(http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=3)確定臨床試驗藥品 的註冊分類 ;透過百度 、 公司官網 、 國家藥品監督管理局資料查詢欄目(http://app1.nmpa.gov.cn/data_nmpa/face3/base.jsp?tableId=25&tableName=TABLE25&title=%B9%FA%B2%FA%D2%A9%C6%B7&bcId=152904713761213296322795806604),搜尋已完成臨床研究相關試驗藥物名稱,對其上市情況進行跟蹤。
採用文獻計量學的方法對收集到的以上眼用製劑的臨床試驗相關資訊進行分析,本研究僅納入透過眼部給藥的臨床試驗專案,不包括透過非眼部給藥方式治療眼科疾病的臨床研究。
2
結 果
2.1 數量與劑型
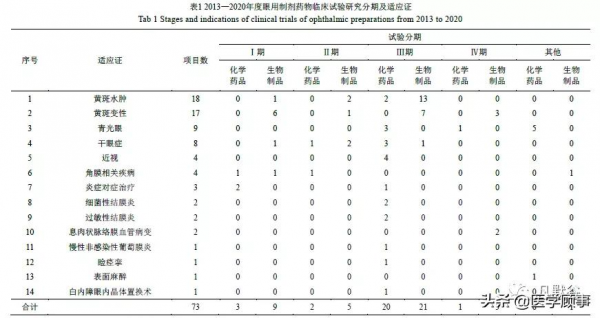
共有 73 項眼用製劑相關的臨床試驗在平臺登記公示,2013 年、2020 年登記專案數最高,均為17 項,2019 年次之,為 13 項。
登記專案試驗藥物劑型包括注射劑、滴眼劑、凝膠劑、植入劑、灌注溶液、乳劑等 6 個劑型,各劑型專案數量排在前三位的分別為注射劑、滴眼劑、凝膠劑。
各年度登記專案數及各劑型專案數情況,詳見圖 1、2。
2.2 申辦者
根據平臺公示資訊統計,34 家國內申辦者共登記眼用製劑臨床試驗專案 51 項;6 家國外申辦者共登記眼用製劑臨床試驗專案 22 項。登記專案數前三位的申辦者分別是成都康弘生物科技有限公司(12 項)、諾華製藥(8 項)、瀋陽興齊眼藥股份有限公司(3 項)。
2.3 臨床試驗藥物類別
根據《藥品註冊管理辦法》(2020 年版)(以下簡稱辦法),藥品註冊按照中藥、化學藥和生物製品等進行分類註冊管理,統計結果顯示註冊進行臨床研究的眼用製劑中無中藥類,化學藥類臨床試驗專案 29 項,生物製品類臨床試驗專案 44 項。
2.4 臨床試驗分期及適應證
藥物臨床試驗分為Ⅰ期臨床試驗、Ⅱ期臨床試驗、Ⅲ期臨床試驗、Ⅳ期臨床試驗以及生物等效性試驗;登記的眼用製劑藥物臨床試驗專案,處於Ⅲ期臨床試驗階段的專案最多,共有 41 項,無生物等效性試驗。
臨床試驗涉及的病種主要為黃斑水腫、黃斑變性、青光眼、乾眼症、近視等。眼用製劑藥物臨床試驗分期及適應證情況如表 1 所示。
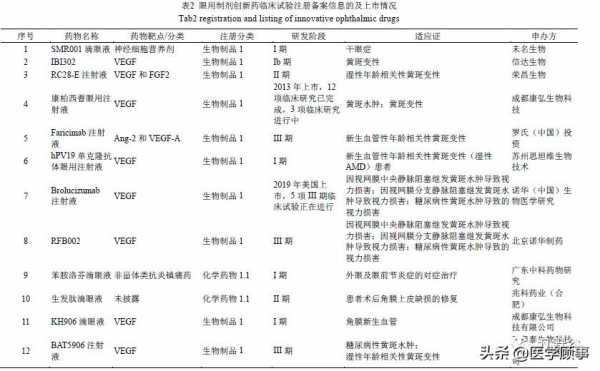
2.5 眼用製劑創新藥臨床試驗註冊備案資訊及上市情況
平臺中眼用製劑創新藥物共有 12 種,其中僅 2 種為化學藥物創新藥,其餘 10 種均為生物製品創新藥;8 種藥物的適應證為黃斑相關疾病,另外 4 種分別為為乾眼症、炎症、角膜修復、角膜新生血管;9 種藥物申辦方為國內公司,佔據主導地位。具體詳見表 2。
適應證為黃斑病變、黃斑水腫等黃斑相關病變的創新藥物,作用靶點均為 VEGF(血管內皮生長因子),另外,RC28-E 注射液還作用於 FGF2(鹼性成纖維細胞生長因子 2),Faricimab 注射液還作用於 Ang-2(促血管生成素-2);SMR001 滴眼液適應證為乾眼症,其屬於神經細胞營養劑;苯胺洛芬滴眼液適應證為外眼及眼前節炎症的治療,苯胺洛芬為 COX(環氧合酶)和 EP3(E-前列腺素受體3)雙受體抑制劑,屬於非甾體類抗炎鎮痛藥;生髮肽滴眼液適應證為患者術後角膜上皮缺損的修復,而其作用機制未見文獻披露。創新藥中,僅康柏西普眼用注射液已在我國上市,其他品種仍在臨床試驗階段。
2.6 眼用製劑非創新藥臨床試驗註冊備案資訊及上市情況
除創新藥物外,平臺中還有 24 種藥物進行了臨床研究,其中 7 種藥物完成研究併成功上市,具體詳見表 3;剩餘 17 種藥物均在試驗過程中。
2.7 國際多中心臨床試驗(international multi-center clinicaltrials,IMCT)
共有 14 項眼用製劑臨床試驗專案為IMCT 專案,其中2013 年6 項,2015 年1項,2019 年6 項,2020 年1 項,所有專案均為III 期臨床研究專案,申辦者多為國外醫藥企業,國內申辦者僅有2 項專案(CTR20191290、CTR20191391)。
3
討 論
3.1 眼用製劑臨床試驗專案數量整體呈現增長態勢
2013 年 9 月,SFDA 釋出《關於藥物臨床試驗資訊平臺的公告》,要求凡獲國家食品藥品監督管理總局臨床試驗批件,並在我國進行的臨床試驗專案,申辦者均應按要求進行臨床試驗登記與資訊公示,從而導致 2013 年眼用製劑臨床試驗登記出現高峰,因為登記專案中也包括了 2013 年以前未登記但仍在進行的臨床試驗。其後,2014—2020 年 7 年間,除了 2017 年較 2016 年登記數量略降外,其餘年份登記數量呈逐年增加趨勢,尤其 2018 年、2019 年、2020 年 3 年增速最快,至 2020 年達高峰(17 項),眼用製劑的研發速度不斷加快。
3.2 臨床試驗專案中眼用製劑劑型以注射劑及滴眼劑為主
註冊的眼用製劑臨床試驗專案中,試驗藥物劑型為注射劑的專案共有 39 項,佔所有專案比例53.42%、滴眼劑的專案為 25 項,佔所有專案比例 34.25%。登記專案中,對於青光眼、乾眼症、各類炎症以及角膜系統手術等眼前節疾病的治療,由於給藥的方便性以及藥物容易達到有效濃度,以滴眼劑等劑型為主。眼部存在較多屏障,藥物遞送的難題並沒有得到解決,注射劑可立即將有效濃度的藥物注入作用部位,所需藥物的劑量很小,並具有較好的療效,即便注射時容易給患者帶來痛苦並造成眼部損傷,註冊專案中黃斑水腫、黃斑變性等眼底疾病的治療,仍均以注射劑為唯一劑型。新型給藥體統諸如:膜劑、脂質體、微球、奈米粒、凝膠等新型眼部給藥載體,雖然在實驗室階段表現出較好的效果,但最終能應用於臨床併為臨床認可者很少【4】。
3.3 創新藥已透過抗 VEGF 治療眼底病變的生物製品為主
12 項創新藥研究中,僅苯胺洛芬滴眼液、生髮肽滴眼液 2 個品種為化學藥物,其餘 10 種藥物均為生物製品。9 項專案的申辦方為國內公司,佔據主導地位,一定程度上反映應了國內藥物研發水平持續提高,尤其在生物製品研發方面具有較強能力。
治療眼底疾病的 8 項臨床試驗中的試驗藥物,作用靶點以血管內皮生長因子(VEGF)為主。新生血管的形成是很多眼部疾病的共同病理過程,刺激眼部新生血管生成的各類受體介導的細胞訊號通路中,VEGF 作用最強。雷珠單抗是第一個以 VEGF 作為靶點的眼科藥物,於 2006 年在美國上市,改變了人類對黃斑病變等眼底頑疾束手無策的局面,開啟了眼底病治療的新時代【5】。後續又上市了阿柏西普、康柏西普、帕唑帕尼、布羅茲單抗、阿比西帕等抗 VEGF 藥物藥物。抗 VEGF 眼科藥物的安全性及有效性得到了大規模臨床試驗的驗證【6-9】。
KH906 滴眼液的有效成分為康柏西普,它能有效地與血管及組織中的 VEGF 結合,阻斷由 VEGF介導的促進新生血管出芽和生長的訊號傳遞,擬用於治療外傷、化學燒傷、角膜移植術後誘發的新生血管等。
RC28-E 注射液作用靶點為 VEGF 和 FGF2。FGF2 與 VEGF 共同參與誘導新生血管的產生,並對VEGF 的生物活性起到增強/協同作用【10】,RC28-E 注射液可有效拮抗視網膜缺血小鼠模型的視網膜新生血管,而且效果顯著優於僅拮抗 VEGF-A 的 VEGF-Trap 對照品【11】。Faricimab 注射液作用於 VEGF-A 和 Ang-2 為作用靶點。視網膜缺血性疾病中,Ang-2 上調,會導致血管滲漏、血管外皮細胞流失,並引起炎症。阻斷 Ang-2 可減少炎症相關的血管滲漏,對眼部新生血管疾病具有治療作用。
Faricimab 透過靶向 Ang-2 和 VEGF-A,II 期臨床試驗標明,其與對照藥物相比,具有更顯著與持久的療效【12】。
SMR001 滴眼液適應證為乾眼症,其屬於神經細胞營養劑;苯胺洛芬滴眼液適應證為外眼及眼前節炎症的治療,苯胺洛芬為 COX 和 EP3 雙受體抑制劑,屬於非甾體類抗炎鎮痛藥【13】;生髮肽滴眼液適應證為患者術後角膜上皮缺損的修復,而其作用機制未見文獻披露。
3.4 臨床試驗相關藥物仍多處於臨床研究階段
2013 年以來登記的臨床研究專案相關藥物,12 種創新藥中,僅有 1 種已完成臨床研究,並上市;其餘 24 種藥物,有 7 種藥物完成臨床研究,並從我國上市,剩餘 17 種藥物均未完成臨床研究。8 種完成臨床試驗並上市的眼用製劑中,7 種藥物為國外已上市藥物,且由原研單位申請國內進行臨床研究,具有較為可靠的療效,而康柏西普眼用注射液完全由國內公司研發上市,表明我國醫藥行業已具備一定的創新藥研發能力。多數藥物仍處在臨床研究階段,與平臺中專案多為近年登記有關,完成臨床研究還需要一定時間。
3.5 IMCT 有待進一步發展
IMCT 是指國內外的多箇中心按照同一臨床試驗方案同時開展臨床試驗,是一種共享資源的藥物開發模式,可以減少不必要的重複臨床試驗,縮短區域或國家間藥品上市延遲,提高患者獲得新藥的可及性也有利於境內申辦者融入國際市場。CFDA 於 2015 年釋出《國際多中心藥物臨床試驗指南(試行)》,並配套相關政策,鼓勵國內醫藥企業開展 IMCT,加速我國藥物研發國際化程序。根據平臺檢索結果,目前國內醫藥企業僅開展了 2 項 IMCT 專案,此類專案開展數量還有待提升。