shuanmen 生信人
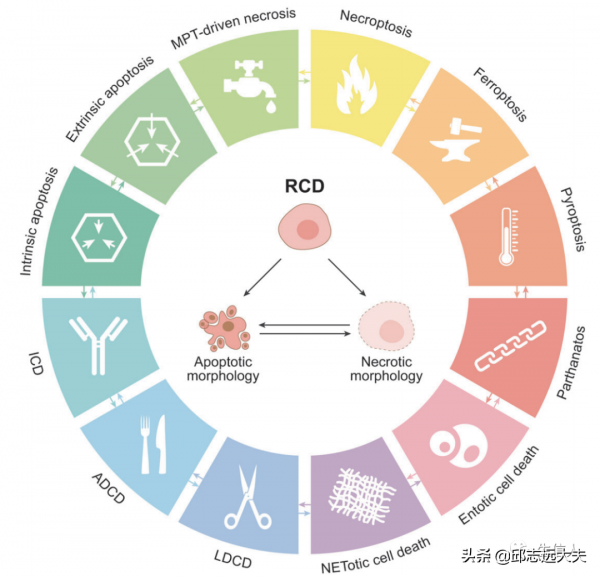
細胞凋亡、鐵死亡、細胞焦亡、壞死性凋亡等概念相信大家都耳熟能詳,各個死亡方式的研究熱度也只增不減。前段時間為大家介紹了一個可供選擇的研究熱點方向:壞死性凋亡。壞死性凋亡和細胞焦亡、細胞凋亡統稱為細胞死亡的複雜遊戲。但不管是哪種細胞死亡方式,都屬於Nomenclature Committee on Cell Death(NCCD)在18年整合的細胞死亡術語(圖1)。
圖1
概念
最新的研究發現,細胞死亡領域缺失了一塊拼圖:PANoptosis。
我們首先來看一下PANoptosis的概念:PANoptosis是一種炎症性程式細胞死亡,受到PANoptosome複合物的調控,具有細胞焦亡(pyroptosis)、凋亡(apoptosis)和/或壞死性凋亡(necroptosis)的關鍵特徵,這也是PANoptosis術語中“P”、“A”和“N”的來源;此外,最重要的一點,PANoptosis不能被細胞焦亡、凋亡和壞死性凋亡中任意一種死亡方式單獨表徵。
分子機制
從時間線來看,隨著凋亡、細胞焦亡和壞死性凋亡研究的逐步深入,PANoptosis的第一個證據在2016年被報道(圖2)。
圖2
PCD間串擾
儘管細胞焦亡、細胞凋亡和壞死性凋亡在研究史上一直被描述為不同的、獨立的pathway,但是越來越多的證據表明這些程式性細胞死亡(PCD)pathway之間存在廣泛的相互作用。目前已經明確了每一對pathway之間的相互作用(細胞焦亡與細胞凋亡,細胞凋亡與壞死性凋亡,細胞焦亡與壞死性凋亡),並且越來越多的研究從機制上定義了三種pathway之間的相互作用。這些發現促成了PANoptosis的建立。
這裡我們主要介紹三種死亡方式之間的串擾,對於兩兩之間的相互作用這裡不做過多介紹。
目前為止,最完善的PANoptosis證據於2016年首次在病毒感染的背景下透過直接的生化證據顯示。其中ZBP1被鑑定為甲型流感病毒(IAV)的感測器和IAV感染期間細胞死亡的主要調節因子。感染IAV的巨噬細胞經歷了PANoptosis細胞死亡,其特徵是CASP1、CASP8、CASP3的啟用和MLKL的磷酸化,這些是細胞焦亡、細胞凋亡和壞死性凋亡的基本分子事件。ZBP1的缺失足以完全抑制PANoptosis,而典型的PCD pathway的個別成分的缺失無法挽救細胞死亡。多種實驗結果表明ZBP1介導的PANoptosis是觸發依賴性的。ZBP1透過其Zα結構域的IAV啟用,可以作為特定的上游事件,啟動分子機制的啟用以進行PANoptosis. 除了IAV感染,在無菌炎症中也顯示了PANoptosis的證據。多個體內遺傳證據表明了三種PCD之間透過PANoptosis進行分子串擾。
除了上述的例子之外,在許多不同的實驗條件下也觀察到了PANoptosis,例如在細胞因子風暴和癌症。目前的實驗證據表明PANoptosis的啟用是多樣化的,調節過程是複雜的。而這種複雜的調節是透過PANoptosome實現的,PANoptosome也就是我們在概念部分提到的複合物,是三種PCD串擾的關鍵平臺。
PANoptosome
蛋白質之間的同型和異型域相互作用為PANoptosome的形成提供了骨架。迄今為止,已經確定了兩種上游分子ZBP1和RIPK1,它們可以響應特定刺激而觸發PANoptosome組裝,但很有可能還有其他分子有待表徵。這裡我們重點介紹ZBP1。
ZBP1-PANoptosome模型:
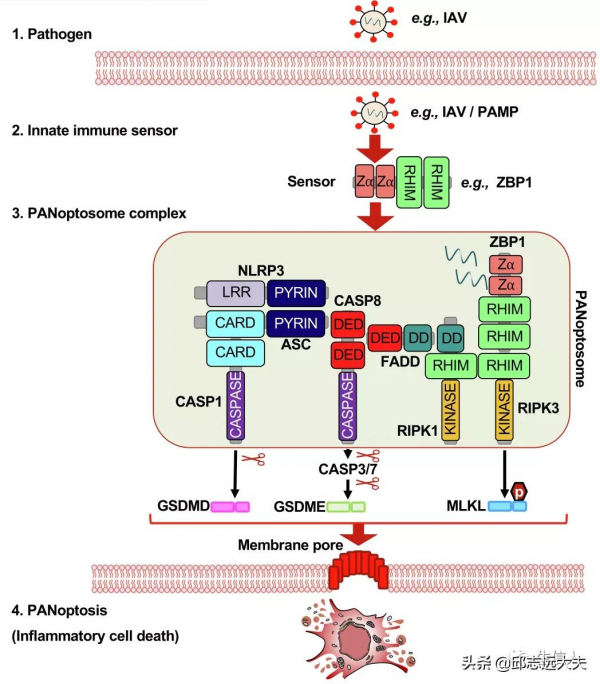
特定觸發器IAV啟動了PANoptosome的形成;ZBP1作為特異的感測器被啟用;感測器啟動PANoptosome的組裝,包括下游PCD效應器所需分子的啟用(包括gasdermins, CASP3/7, MLKL);最後,由細胞焦亡、細胞凋亡和壞死性凋亡pathway成分參與的PANoptosis啟動,導致溶解性炎症細胞死亡(圖3)。
圖3
Cell Reports 最新PANoptosis研究
作為一種全新的概念,PANoptosis到底應該如何開展研究呢?小編結合今年最新的Cell Reports文章,為大家介紹腫瘤中如何探索PANoptosis致癌機制和潛在治療策略。
Highlights
IFNs與NEIs聯合誘導ZBP1介導的炎症細胞死亡,PANoptosis
ADAR1負向調控ZBP1介導的PANoptosis
阻斷ADAR1活性可釋放ZBP1介導的PANoptosis抑制腫瘤發生
在小鼠模型中,IFN-γ+KPT-330以ZBP1依賴的方式顯著抑制腫瘤
摘要
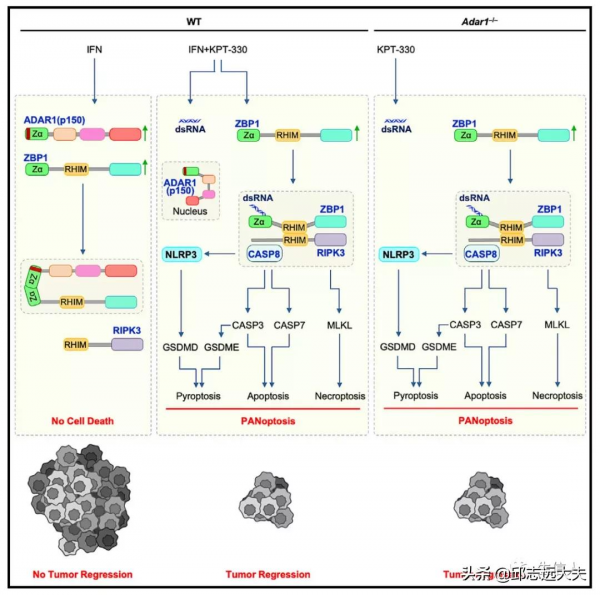
細胞死亡提供宿主防禦並維持體內平衡。含Zα的分子對於這些過程是必不可少的。ZBP1啟用炎症細胞死亡(PANoptosis),而作用於ADAR1的腺苷脫氨酶作為RNA編輯器來維持體內平衡。因此作者想確定並表徵ADAR1與ZBP1的相互作用,定義其在細胞死亡調節和腫瘤中的作用。
結果
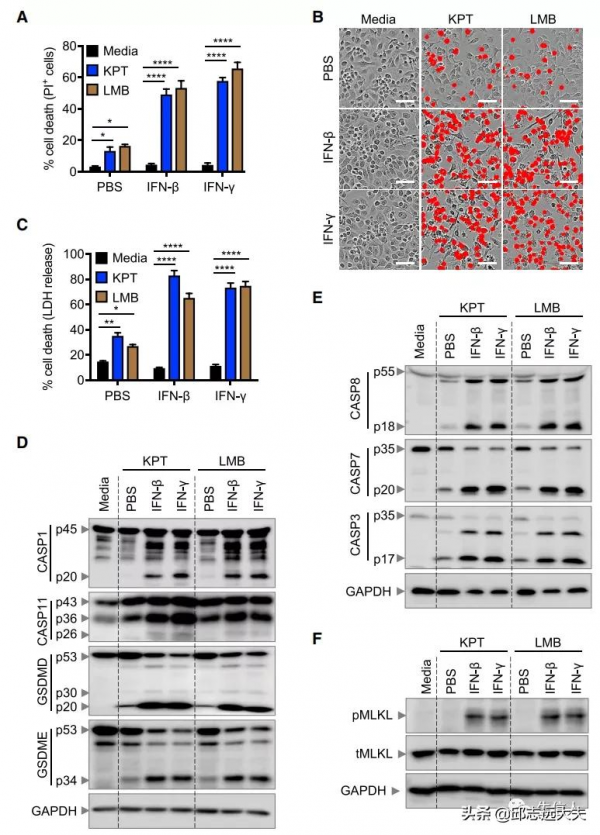
1.干擾素訊號增強核轉運抑制劑誘導的細胞死亡
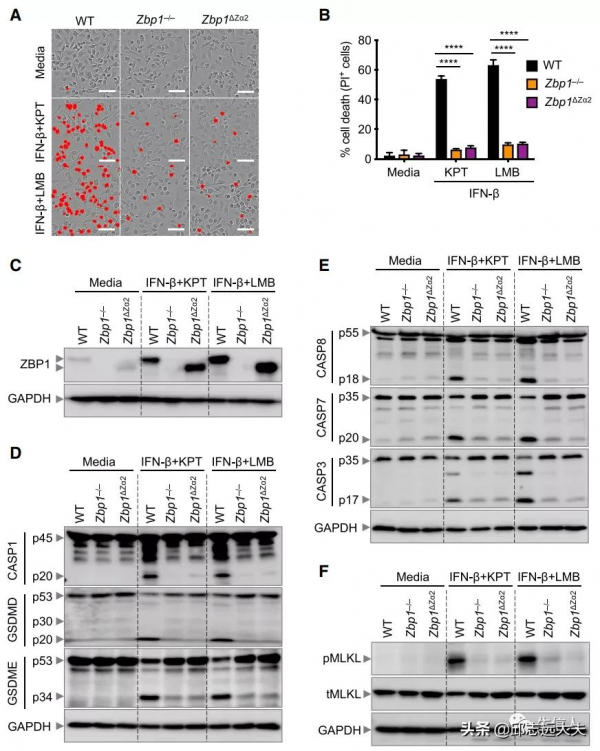
為了從分子上定義NEI誘導的細胞死亡pathway,使用NEI KPT-330或LMB處理了BMDM。用KPT-330或LMB處理24小時在BMDM中誘導低水平的細胞死亡。隨後評估了NEI與IFN組合誘導的細胞死亡機制。總的來說,將IFN與NEI結合可使細胞敏感地經歷炎症小體啟用和細胞死亡,涉及細胞焦亡、細胞凋亡和壞死性凋亡的成分,表明PANoptosis正在發生。
2.ZBP1透過RIPK3訊號啟用NEI誘導的NLRP3炎症小體和PANoptosis
先天免疫感測器在啟用炎性體和驅動細胞死亡方面發揮著關鍵作用。因此,作者首先研究了已知組裝炎性體的細胞溶質感測器是否在這些條件下啟用caspase-1並誘導細胞死亡;隨後,篩選了已知在各種情況下調節炎症小體啟用和細胞死亡的其他先天免疫感測器。結果表明,ZBP1的Zα2結構域需要啟用RIPK3訊號傳導以誘導NLRP3炎性體的啟用和細胞死亡的執行,這取決於GSDMD和GSDME共同響應IFN和NEI的組合。
3.ADAR1抑制ZBP1介導的NLRP3炎症小體啟用和PANoptosis
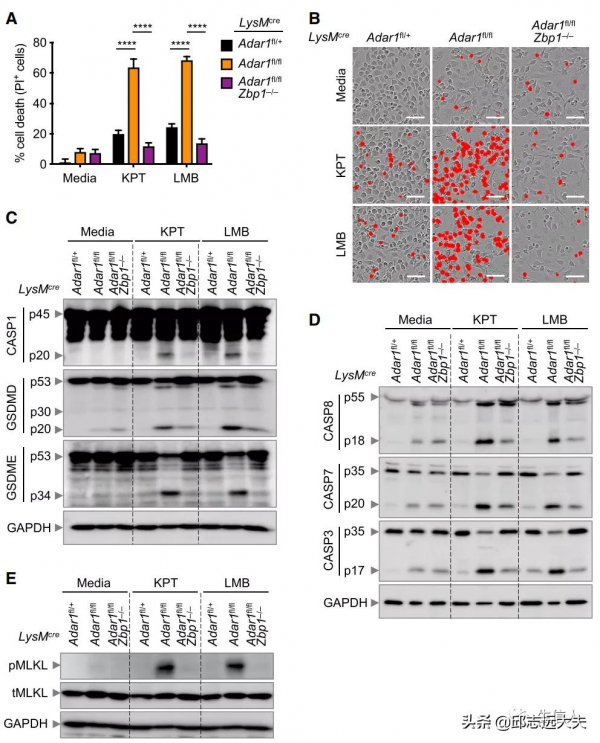
鑑於ADAR1-p150和ZBP1都包含Zα結構域,因此很容易推測ADAR1可以與ZBP1類似地發揮作用並促進炎症小體啟用和PANoptosis。透過小鼠實驗與實時細胞死亡分析發現ADAR1缺陷BMDMs加速了細胞死亡,ADAR1的缺乏導致ZBP1表達增加,ADAR1抑制NEI誘導的NLRP3炎性體啟用和PANoptosis.
4.干擾素促進NEI產生ERE以啟用ZBP1
儘管從根本上上調了ZBP1表達,但Adar1–/–BMDMs仍然需要用NEI治療以驅動炎症細胞死亡。因此,作者假設KPT-330或LMB會誘導啟用ZBP1的觸發器的釋放。實驗結果表明WT細胞中的IFN引發增強了NEI增加內源性dsRNA水平的能力,隨後ZBP1可以感知這些水平以介導炎症細胞死亡。
5.ADAR1與RIPK3競爭ZBP1結合以抑制炎症小體啟用和細胞死亡
因為ZBP1和ADAR1都含有Zα結構域,所以ADAR1可能透過Zα結構域與ZBP1相互作用,從而限制了ZBP1與RIPK3結合並抑制隨後的細胞死亡的可用性。因此,作者試圖確定ZBP1是否可以在不同條件下與WT BMDM中的 ADAR1 內源性相互作用。實驗結果表明ADAR1透過ZBP1 Ζα結構域與ZBP1相互作用,這種相互作用限制了ZBP1與RIPK3結合以啟用PANoptosis的可用性。
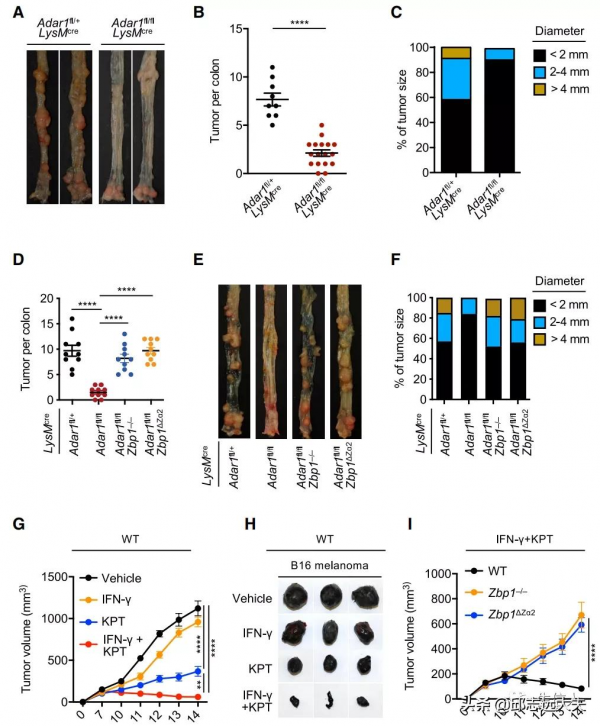
6.ADAR1透過抑制ZBP1介導的炎症細胞死亡促進腫瘤發生
失調的細胞死亡和炎症反應與腫瘤發生有關。抵抗細胞死亡,尤其是細胞凋亡,是癌症的基本標誌之一。為了研究ADAR1和ADAR1介導的細胞死亡在腫瘤發生中的作用,作者利用細胞系和小鼠模型,發現ZBP1,尤其是其Zα2結構域,在抑制腫瘤發生中對干擾素和NEI聯合治療的反應至關重要。
總結
PANoptosis目前可以說是最複雜的細胞死亡形式,既包含細胞焦亡、細胞凋亡和壞死性凋亡,又不能被任何單一死亡形式所表徵。作為一種全新的概念,研究前景是肉眼可見,如果有完備的實驗解析分子機制,那麼復刻細胞焦亡的NATURE級別的文章也不是不可能。此外,在已有的研究基礎上,從生信角度,刻畫腫瘤中的調控機制,同樣大有可為。