胃腸道(gastrointestinal, GI)所有器官均由胚胎髮育過程中源自三原胚層的細胞組裝而成,且是正確執行胃腸道複雜功能所必需的。比如說,胃以化學和機械方式分解食物的關鍵功能取決於內胚層形成的上皮細胞之間複雜的相互作用以產生胃酸和蛋白酶,中胚層發育而來的平滑肌控制縮放,而外胚層而來的腸道神經負責協調前兩個過程。
近端胃腸道的先天性和獲得性疾病包括食管閉鎖、胃輕癱和胃食管反流病,這些疾病可能由上皮、腸道神經系統(enteric nervous system, ENS)或平滑肌發育不當引起。儘管動物模型對於研究胃食管的發育和疾病非常重要,但不同物種在該器官中存在巨大的結構和功能差異,例如齧齒動物就具有人類不存在的前胃,Hedgehog訊號在雞和小鼠胚胎中胃腸平滑肌的發育中也具有不同作用【1】。因此,建立一種可在體外操作的遺傳易處理且複雜的人類GI 組織模型可以加速改善胃食管功能藥物的開發和研究。然而,當前的胃和食管類器官模型的侷限性在於它們僅包含上皮組織【2, 3】,因此,迫切需要在體外整合來自其他兩個胚層的祖細胞從而增加食管類器官的複雜性。
2021年12月1日,來自美國辛辛那提兒童醫院醫學中心的James M. Wells團隊在Cell Stem Cell雜誌上發表了一篇題為 Functional human gastrointestinal organoids can be engineered from three primary germ layers derived separately from pluripotent stem cells 的文章,該團隊開發了由源自人類多能幹細胞的三原胚層的細胞組裝而成的包含功能性腸道神經元、平滑肌層和分化腺體的人胃類器官,利用該系統證明人類腸神經嵴細胞(enteric neural crest cells, ENCCs)對胃上皮和間充質發育的關鍵作用,併為其他複雜類器官的開發提供了一個強大的範例。
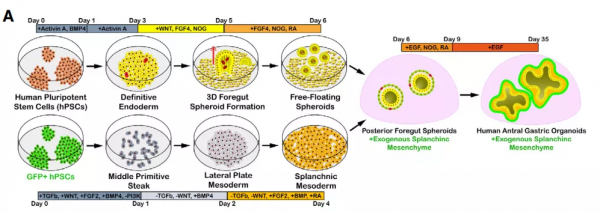
胃腸道發育的第一個,也是最關鍵的步驟之一是將上皮細胞和間充質組裝成原始腸道管。儘管多能幹細胞衍生的人胃類器官具有完整的上皮細胞型別,但它們本質上並沒有形成強大的間充質【2, 3】。為此,作者根據最近建立的一種方法,直接將人多能幹細胞分化為胃間充質細胞的來源,即內臟間充質細胞(splanchnic mesenchyme, SM)【4】,並嘗試將間充質納入胃類器官發育,透過標記物鑑定確認具有間充質包裹上皮的胃竇類器官(hAGOs)生成(圖1)。緊接著,作者將有無間充質的hAGOs移植到小鼠體內培養,結果顯示約60%沒有新增間充質的hAGOs 沒能繼續生長,即使存活下來也僅有簡單的未完全分化的結構,相反,那些具有間充質的hAGOs具有100%的存活率,說明間充質的的摻入能促進hAGOs在體內的生長。
圖1. 由人多能幹細胞衍生hAGO+SM類器官方法示意圖
需要注意的是,儘管SM能促進hAGOs的生長,但上皮並未發育成類似於人胃的腺體結構。為了解決這個問題,作者基於先前的研究從人多能幹細胞中獲取ENCCs,將其與hAGOs+SM在體外重組後再次移植到小鼠體內,並驚喜地發現hAGO+SM+ENCCs移植物具有嵌入腸道神經元網路的平滑肌層,且其組織方式類似於人38周的胎兒胃,幷包含胃竇細胞型別,比如粘液細胞、表達生長素釋放肽、組胺和胃泌素的內分泌細胞等。採用類似的方法,作者還生成了胃底類器官(hFGOs),hAGOs和hFGOs在移植後仍能保持它們的區域特性,通常將人類胃底與胃竇區分開來的細胞型別比例也同樣能將hAGOs與hFGOs區分開。
從組織結構上來看hAGOs和hFGOs類似於人胃,那麼功能上呢?胃對食物的機械分解和十二指腸的排入涉及ENS對平滑肌的收縮控制。作者將從hAGOs分離的組織置於器官水浴系統檢測其收縮性,來判斷是否存在功能性神經肌肉單位。可以觀察到源自hAGO+SM+ENCC的組織存在高度規則的自發收縮振盪,而hAGO+SM的收縮活動則是不規則的。此外,將分離的組織暴露於電場刺激(EFS),僅導致hAGO+SM+ENCC收縮活動增加,表明ENS對平滑肌的調節,如果新增神經毒素TTX阻斷ENS功能,也消除了平滑肌的收縮活動。
在構建類器官的過程中,作者還發現ENCCs能引起上皮周圍的間充質細胞增加2-4倍,且與胃間充質細胞基因BARX1、NKX3-2等的表達水平增加相關,說明腸道神經元在促進對於生成胃特異性間充質細胞。此外,作者將hAGO+ENCC移植到小鼠體內,研究在沒有間充質的條件下ENCCs如何影響上皮發育。作者發現,在21個移植物中有5個存在明顯的腺上皮形態發生,而19個沒有ENCCs的hAGO均未有上皮形態發生,這一發現說明如果沒有足夠的間充質參與,單獨新增ENCCs不會導致正常胃的發育,但也會促進hAGO的存活和部分移植物中腺上皮的發育。然而,這些腺上皮並不表達關鍵的胃或腸特異性上皮標誌物,而與十二指腸近端黏膜下層,靠近幽門連線處的Brunner腺體相似,說明ENCCs需要強大的間充質細胞群來促進胃腺形態發生,即間充質和ENCCs的訊號協同作用對於維持胃特徵而言十分重要。
除了胃竇和胃底類器官,作者還利用上述方法設計了食管類器官,說明透過組合三個胚層祖細胞來設計不同胃腸道器官的可行性,同時也強調了上皮、間充質和ENCCs細胞間通訊對於胚胎器官的正確組裝和功能的重要性,為重建先天性GI疾病和上消化道急性損傷模型提供了研究材料。
原文連結:
https://doi.org/10.1016/j.stem.2021.10.010
參考文獻
1. Huycke, T.R., Miller, B.M., Gill, H.K., Nerurkar, N.L., Sprinzak, D., Mahadevan, L., and Tabin, C.J. (2019). Genetic and Mechanical Regulation of Intestinal Smooth Muscle Development. Cell 179, 90–105.e21.
2. McCracken, K.W., Cata´ , E.M., Crawford, C.M., Sinagoga, K.L., Schumacher, M., Rockich, B.E., Tsai, Y.H., Mayhew, C.N., Spence, J.R., Zavros, Y., and Wells, J.M. (2014). Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature 516, 400–404.
3. McCracken, K.W., Aihara, E., Martin, B., Crawford, C.M., Broda, T., Treguier, J., Zhang, X., Shannon, J.M., Montrose, M.H., and Wells, J.M. (2017). Wnt/b-catenin promotes gastric fundus specification in mice and humans. Nature 541, 182–187.
4. Han, L., Chaturvedi, P., Kishimoto, K., Koike, H., Nasr, T., Iwasawa, K., Giesbrecht, K., Witcher, P.C., Eicher, A., Haines, L., et al. (2020). Single cell transcriptomics identifies a signaling network coordinating endoderm and mesoderm diversification during foregut organogenesis. Nat. Commun. 11, 4158.