肌萎縮側索硬化症(ALS)是由大腦和脊髓運動神經元選擇性變性引起的,然而,介導運動神經元死亡的主要細胞死亡途徑仍不清楚。作者最近證實,壞死凋亡,一種調節細胞死亡的炎症形式,對於ALS小鼠模型中的運動神經元死亡是可有可無的,這意味著其他形式的細胞死亡。在這裡,作者證實了ALS患者的這些發現,顯示脊髓中缺乏關鍵的壞死效應蛋白的表達。
圖片來源:https://doi.org/10.1038/s41418-021-00910-z
肌萎縮側索硬化症的選擇性運動神經元丟失可歸因於多種細胞死亡途徑,包括細胞凋亡、內質網應激誘導的細胞死亡、自噬細胞死亡和壞死性凋亡。在ALS人源化細胞共培養模型中的藥理抑制和遺傳消融研究已經確定了運動神經元死亡的非凋亡模式。在這裡,作者證實了鐵凋亡,一種最近被描述的鐵依賴的RCD途徑,介導了ALS中選擇性運動神經元的死亡。
幾十年來積累的多條證據,包括ALS受影響的中樞神經系統區域的鐵積累、抗氧化失衡和脂質過氧化,都與鐵死亡有關。此外,最近發現人類誘導的多能幹細胞來源的運動神經元在體外發生鐵死亡,而神經元gpx4消融則導致小鼠運動神經元死亡和癱瘓。最後,鐵死亡的血液標誌物,包括過氧化脂質、鐵蛋白和轉鐵蛋白,與ALS預後相關。
在這裡,作者無法在ALS患者和健康對照組的脊髓中檢測到RIPK1和MLKL。這一結果與最初報道的肌萎縮側索硬化症患者脊髓中RIPK1、RIPK3和MLKL的積聚和啟用形成對比。雖然這可能反映了ALS患者群體的差異,如疾病異質性、組織收集和準備,但血源性細胞和免疫細胞浸潤可能有助於中樞神經系統壞死標記訊號,而不是反映真正的神經元或膠質細胞壞死。
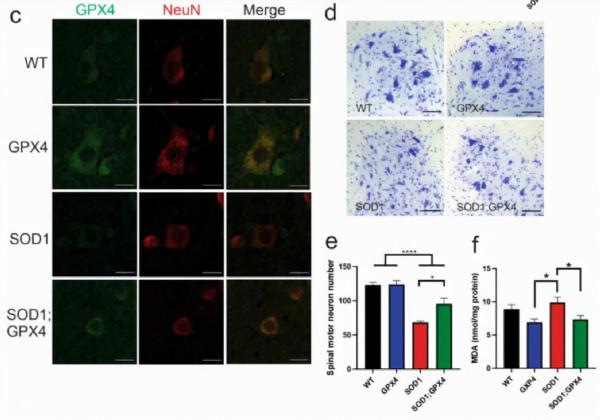
Gpx4缺失在家族性和散發性ALS患者以及ALS的三種不同的遺傳小鼠模型中都很常見,認為Gpx4失調在ALS中是普遍存在的。Gpx4下調不是神經變性的結果,因為在SOD1G93A小鼠的脊髓和皮質中,Gpx4水平提前下降,出現先兆症狀和運動神經元丟失。
作者進一步研究發現Gpx4主要定位於脊髓中的運動神經元,與先前的研究一致,提示運動神經元中Gpx4的耗竭和鐵性下垂是一種細胞自主效應。
為了證實鐵死亡在體內介導運動神經元死亡中的直接作用,作者構建了新的BAC轉基因人Gpx4小鼠。這些小鼠在所有被評估的組織中都過表達人gpx4,主要是在脊髓、腦和骨骼肌,這與gpx4在神經肌肉系統中的基本抗氧化和抗鐵死亡作用是一致的。
研究結果發現SOD1G93A小鼠與轉基因Gpx4小鼠雜交,雙轉基因小鼠的症狀和病理均有改善。重要的是,Gpx4的過表達透過延遲疾病發作來延長生存期,這再次與ALS的細胞自主效應相一致。
預防鐵死亡可以挽救SOD1G93 A小鼠的運動神經元丟失
圖片來源:https://doi.org/10.1038/s41418-021-00910-z
綜上所述,本研究表明,在ALS患者和多種小鼠模型的脆弱中樞組織中,Gpx4介導的反鐵聯體防禦功能受損。Gpx4過表達可恢復鐵死亡防禦,抑制脂質過氧化和運動神經元死亡,改善運動功能和預後。因此,Gpx4通路的藥理學靶向和啟用為ALS的潛在有效治療提供了一條很有前途的途徑。