激酶是催化磷酸基團從 ATP 轉移到特定蛋白質或小生物分子(包括脂質和碳水化合物)的酶。磷酸化對底物施加結構變化,影響其與其他分子結合的能力、其亞細胞定位和/或其催化活性。激酶磷酸化控制複雜細胞過程的分子,例如生長、增殖、分化、運動和細胞凋亡。由於它們在調節細胞內穩態和細胞外訊號轉導中的不可或缺的作用,激酶活性的失調直接涉及許多進行性疾病,包括癌症。增加對疾病生物學的瞭解有助於驗證多種蛋白質和脂質激酶作為藥物靶點,從而推動對藥物發現計劃的大量投資。如今,全球80多種激酶抑制劑的臨床批准證明了這些努力的成功,其中66種在 1999年至2020年期間在美國獲得批准(圖1),其中大部分用於癌症治療,但也用於治療代謝和自身免疫性疾病。
圖1. FDA 批准的小分子激酶抑制劑從 1999 年到 2020 年用於治療癌症(橙色)、非癌症適應症(藍色)或兩者(橙藍線)(圖片來源:J. Med. Chem)。
1. 1999 年至2010年FDA批准的激酶抑制劑
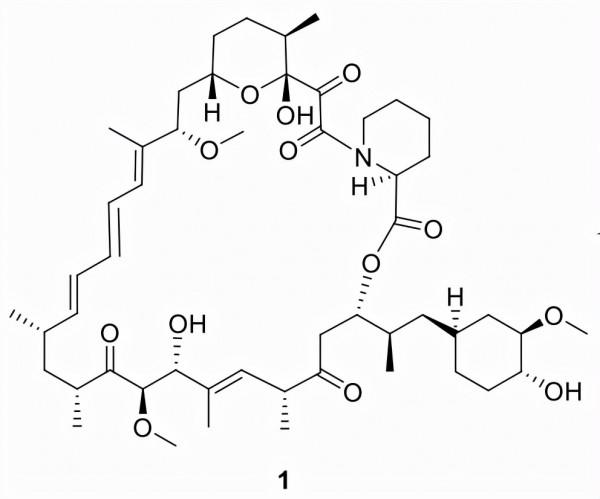
西羅莫司 (1)
由Ayerst Research Laboratories 發現(雷帕黴素;AY-22989),被輝瑞收購,並以 Rapamune銷售,1於1999年首次被批准用於預防13歲以上接受腎移植的患者的器官排斥。 2015年,該藥物還被批准用於治療淋巴管平滑肌瘤病(LAM)患者。
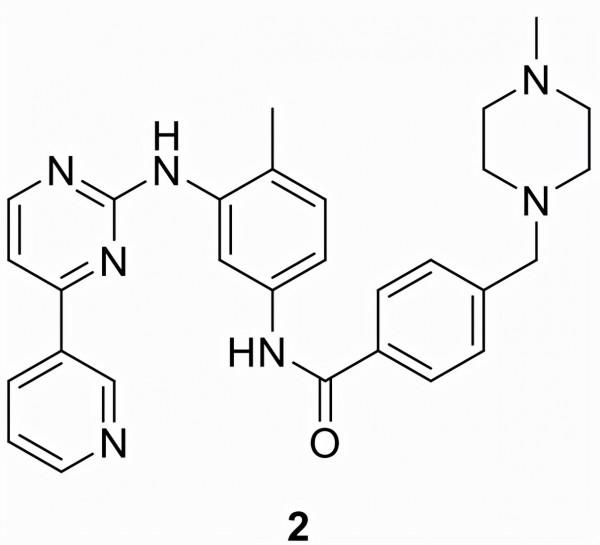
伊馬替尼 (2)
依馬替尼(2)以Gleevec/Glivec (STI-571)為名上市,由 Ciba-Geigy(現為諾華)開發。在臨床試驗中的成功導致 FDA於2001年批准用於治療費城染色體陽性 (Ph+) 慢性粒細胞白血病 (CML)的所有階段,創紀錄的時間為治療後三年第一個病人。隨後的I和II期臨床試驗在2002年擴大了2作為治療胃腸道間質瘤 (GIST) 的批准。
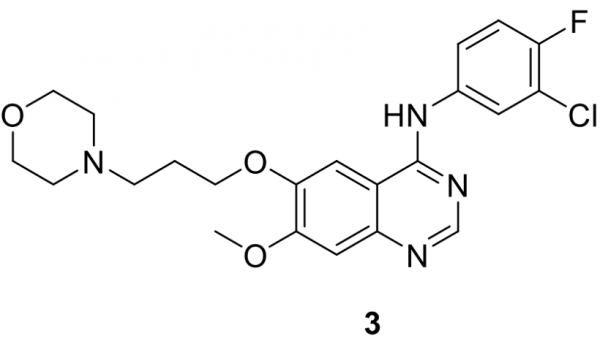
吉非替尼 (3)
由阿斯利康 (AstraZeneca) (AZD-1839) 開發並以易瑞沙 (Iressa) 銷售的3於 2003年獲得加速批准,用於治療對化療無反應的晚期非小細胞肺癌 (NSCLC) 患者。然而,在隨後的臨床研究不成功之後,FDA 將 3 的使用限制在已經從其治療中受益的患者身上。增加對 EGFR 突變及其在 NSCLC 中作用的理解使得能夠為攜帶 EGFR 基因外顯子 19 缺失或外顯子 21 (L858R) 替代突變的 NSCLC 患者設計分層試驗,從而導致 3 於2015 年作為第一個獲批針對這些患者的一線治療用藥。
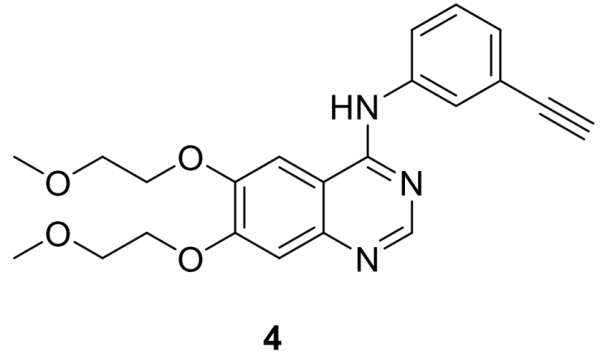
厄洛替尼 (4)
由OSI Pharmaceuticals (OSI-774) 與 Genentech 和 Roche Pharmaceuticals 合作開發,並以 Tarceva 的名稱銷售,4於2004年首次被批准用於治療晚期或轉移性 NSCLC患者作為二線或更高線治療,在失敗後至少一種既往化療方案。 2005年,4進一步獲批與吉西他濱聯合用於區域性晚期、不可切除或轉移性胰腺癌患者的一線治療。 2010年,有4個獲批用於接受4個週期鉑類一線化療後疾病未進展的NSCLC患者的維持治療。4最近的批准是在 2013 年,作為轉移性 NSCLC 患者的一線治療,這些患者的腫瘤具有 EGFR 外顯子 19 缺失或外顯子 21 (L858R) 替代突變。
索拉非尼 (5)
由拜耳製藥公司 (BAY439006) 開發並以多吉美 (Nexavar) 的商品名銷售,5 於 2005年被 FDA 批准用於治療晚期腎細胞癌 (RCC)。高無進展率的II期試驗的成功導致III期 (TARGET) 試驗確認5對 RCC 的活性和安全性,支援該藥物的批准。進一步的臨床研究使用5聯合貝伐單抗、厄洛替尼、卡鉑、紫杉醇、干擾素-α、替西羅莫司和西妥昔單抗治療多種實體瘤。化合物5分別於 2007年和 2013年獲得FDA批准用於治療不可切除的肝細胞癌 (HCC) 和轉移性分化型甲狀腺癌。
達沙替尼 (6)
由百時美施貴寶 (BMS-354825) 開發並以商品名 Sprycel 銷售,6於2006年獲得FDA的加速批准,用於治療具有耐藥性的慢性粒細胞白血病 (CML) 和Ph+ 急性淋巴細胞白血病 (Ph+ ALL)或對先前治療不耐受,包括使用2的治療。全球四項 II 期研究證明了6的有效性和安全性。2010 年,一項III期、隨機、開放標籤試驗支援批准6作為慢性期 CML 的一線治療。
舒尼替尼 (7)
由 Pfizer, Inc. (SU11248) 開發並以商品名Sutent商業化,7於2006年被 FDA 批准用於治療疾病進展或不耐受2後的GIST以及治療晚期RCC,後者在加快審批的規定。7的批准基於一項隨機雙盲安慰劑對照試驗的結果,該試驗涉及312 名GIST患者,這些患者在接受2治療或不耐受2時出現疾病進展。對於RCC,對患者的單臂研究對細胞因子治療有抗性的轉移性RCC顯示出作為二線治療的抗腫瘤活性。
拉帕替尼 (8)
由葛蘭素史克 (GlaxoSmithKline) (GW572016) 開發並以 Tykerb 的商品名銷售,8於2007年被FDA批准用於治療晚期轉移性乳腺癌患者,這些患者的腫瘤過度表達HER2且已接受過先前治療,包括蒽環類、紫杉烷、和曲妥珠單抗。在接受曲妥珠單抗(單克隆HER2抗體)治療的一部分患者中出現耐藥性和腦轉移導致了這種EGFR(ErbB1)和HER2(ErbB2)抑制劑的開發。臨床前研究的成功導致8的臨床批准,包括在先前接受過治療的晚期或轉移性乳腺癌患者中進行的III期試驗,證明了8與卡培他濱聯合使用的有效性和安全性,這支援 FDA在2010年將其批准作為一線治療。
尼羅替尼 (9)
由諾華 (Novartis) (AMN107) 開發並以 Tasigna 的商品名銷售,9於2007年被批准用於治療對先前治療有抵抗力或不耐受的成年患者的慢性期和加速期 Ph+ CML,並於2010年作為一線治療用於慢性期的CML。9的有效性和安全性是在 III期隨機開放試驗中確定的,該試驗比較了兩種劑量的9和2。
替西羅莫司 (10)
由惠氏製藥 (CCI-779) 開發並以 Torisel 銷售,10於2007年獲得批准用於治療晚期 RCC。
依維莫司 (11)
由Sandoz開發,後來與諾華 (RAD001) 合併,並以 Afinitor 或 Zortress 銷售,11最初於2009年被批准用於預防移植器官排斥。同年,11獲批用於治療5或7治療失敗的晚期RCC患者。在這些獲批後,11的用途擴充套件到治療與結節性硬化症(TS)相關的需要治療干預,但不是治癒性手術切除的候選者的室管膜下鉅細胞星形細胞瘤(SEGA)(2010);不可切除的、區域性晚期或轉移性胰腺起源的進行性神經內分泌腫瘤 (PNET) (2011);不需要立即手術的腎血管平滑肌脂肪瘤和結節性硬化症 (TSC) (2012);在來曲唑或阿那曲唑治療失敗後,患有晚期激素受體陽性、HER2 陰性乳腺癌(晚期 HR+ BC)的絕經後婦女與依西美坦聯合用藥(2013 年);胰腺來源的PNET和成人進行性、分化良好、非功能性胃腸道或肺來源的神經內分泌腫瘤 (NET),不可切除、區域性晚期或轉移性 (2016); 2歲及以上患有結節性硬化症 (TSC) 相關部分性癲癇發作的成人和兒童患者的輔助治療(2018年)。
帕唑帕尼 (12)
帕唑帕尼 (12)由葛蘭素史克 (GlaxoSmithKline) (GW786034) 開發,現在由諾華公司以Votrient的商品名生產,12於2009年被FDA批准用於治療晚期RCC。 (8) 在轉移性腎細胞癌患者中進行了有希望的II期試驗後,在一項隨機、雙盲III 期試驗中評估12的療效和安全性,支援批准12。2012年,FDA批准了12用於之前接受過化療的患有晚期軟組織肉瘤的晚期軟組織肉瘤的患者。
3. 2011-2015年FDA批准的激酶抑制劑
克唑替尼 (13)
由輝瑞 (PF-2341066) 開發並以 Xalkori 銷售的克唑替尼 (13)於2011年獲得加速批准,用於治療腫瘤為ALK陽性的非小細胞肺癌患者。 2016年,13獲批用於治療腫瘤ROS1陽性的患者。克唑替尼最新的批准是在ROS1 重排 NSCLC 的幾項臨床試驗之後獲得的。 ROS1重排已被確定為NSCLC的致癌驅動因素,在 1-2% 的患者中發現,並定義了一個獨特的NSCLC分子亞組,因為在同一腫瘤中發生的 ALK 和 ROS1 重排很少見。
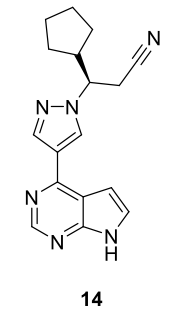
魯索替尼 (14)
由Incyte Corp. (INCB018424) 在研究調節Janus激酶 (JAK) 活性的新型取代吡咯並[2,3-b] 吡啶和吡咯並[2,3-b]嘧啶時開發,在 FDA於2011年批准用於治療中危或高危骨髓纖維化患者,包括原發性骨髓纖維化、真性紅細胞增多症後骨髓纖維化和原發性血小板增多症後骨髓纖維化之後,14以Jakafi的名稱進行銷售。化合物14被指定為孤兒藥,成為第一個專門批准用於治療骨髓纖維化的藥物。
凡德他尼 (15)
由阿斯利康 (AZD-6474) 發現並以 Caprelsa 銷售的15於2011年獲得批准,用於治療不可切除的區域性晚期或轉移性疾病患者的症狀性或進展性甲狀腺髓樣癌 (MTC)。化合物15是第一個獲批用於該適應症的靶向藥物。
威羅非尼 (16)
威羅非尼(16)由 Plexxikon (PLX4032, RG7204) 開發,並以Zelboraf的名義上市,16於2011年被FDA批准為致癌BRAF的一流抑制劑,用於治療具有 BRAF-V600E 突變的不可切除或轉移性黑色素瘤患者。同時,針對 BRAF-V600E 突變 (cobas 4800) 的實時 PCR 診斷測試由 Roche Molecular Systems, Inc. 開發,並與 16 一起被批准作為患者分層工具。I、II、和 III 期試驗表明,先前未經治療的具有 BRAF-V600E 突變的轉移性黑色素瘤患者的總生存率和無進展生存率提高。與 31聯合的臨床試驗支援FDA在2015年批准該組合用於治療具有 BRAF-V600E 或 BRAF-V600K 突變的不可切除或轉移性黑色素瘤患者。
阿西替尼 (17)
由輝瑞 (Pfizer) (AG013736) 開發並商業化為 Inlyta,17於2012年被批准用於治療先前一種全身治療失敗後的晚期RCC。批准前的臨床試驗已在別處審查過。用VEGFR抑制劑治療的轉移性RCC患者出現耐藥性,導致其與免疫檢查點抑制劑(抗 PD-1)如 avelumab 或 pembrolizumab 聯合給藥。臨床試驗的積極結果支援這些組合在2019年獲得批准。
博舒替尼 (18)
由Wyeth Pharmaceuticals, Inc. (SKI-606) 開發並以商品名 Bosulif 銷售,博舒替尼 (18)於2012年被批准作為慢性、加速或急變期 Ph+ CML 成人患者的二線治療,對先前的耐藥或不耐受治療。2017 年,批准範圍擴大到包括新診斷的 Ph+ CML。之前用2治療的患者的關鍵II期單臂試驗顯示出與 2 或 9 相當的良好且持久的細胞遺傳學反應。
卡博替尼 (19)
由 Exelixis (XL184) 開發,授權給 Bristol-Myers Squibb (BMS-907351),並以 Cometriq(膠囊)和 Cabometyx(片劑)的形式銷售,19(作為 Cometriq)於 2012 年被批准用於治療進展性患者, 轉移性MTC。 2016年,19(作為 Cabometyx)被批准用於治療先前接受過抗血管生成治療的晚期 RCC。一年後,該藥物被定期批准為晚期 RCC 患者的一線治療。 2019年,卡博替尼 (19)最新獲批用於治療既往接受過5個治療的HCC患者。
普納替尼 (20)
由ARIAD Pharmaceuticals (AP24534) 開發並以 Iclusig的商品名銷售,20於 2012年被批准作為CML患者的三線治療。I期臨床試驗結果顯著,包括BCR-ABL T315I突變的CML患者。 (177) II 期試驗,包括 T315I 突變和/或對6或 9耐藥的患者,證實了針對該突變的臨床療效。 (178,179) 在這些試驗的基礎上,它被FDA批准為T315I陽性CML(包括加速期、慢性期或急變期)或 T315I 陽性 Ph+ ALL 成人患者的三線治療選擇。一項在新診斷患者中比較20和2的III期研究在幾個月後因20治療後危及生命的動脈血栓事件而被取消,並暫停銷售,直到提交更詳細的風險收益資訊。
瑞戈非尼 (21)
由拜耳 (BAY734506) 開發並以商品名 Stivarga 銷售,21於2012年獲得FDA 批准用於治療先前接受過氟嘧啶、奧沙利鉑和伊立替康治療的轉移性結直腸癌 (CRC) 患者化療,抗 VEGF 療法,或者,如果 KRAS 野生型,抗 EGFR 療法。 2013年,21獲批用於治療既往接受過 2 和 7 治療的區域性晚期、不可切除或轉移性 GIST 患者,2017年批准用於治療既往接受過5治療的 HCC 患者。兩項主要臨床試驗獲得了首次批准:關鍵的III期SHARP試驗和III期RESORCE研究。
託法替尼 (22)
由輝瑞 (Pfizer) (CP-690550) 開發並以 Xeljanz 銷售,22是透過高通量篩選和先導最佳化JAK3抑制劑發現的,用於治療自身免疫性疾病和器官移植排斥。 2012年,22首次獲得FDA批准,用於治療對甲氨蝶呤反應不足或不耐受的中度至重度活動性類風溼性關節炎患者。從那時起,22已被批准用於治療銀屑病關節炎和潰瘍性結腸炎。
阿法替尼 (23)
由勃林格殷格翰 (BIBW-2992) 開發並以Gilotrif上市銷售,23於2013年被批准作為具有EGFR啟用突變(外顯子 21 L858R 和外顯子19缺失)的轉移性 NSCLC的一線治療。 2016年,23也被批准用於治療轉移性鱗狀非小細胞肺癌患者在鉑類化療後進展。 2018年,23藥物的批准範圍擴大,用於攜帶S768I、L861Q或G719X等非耐藥EGFR突變的轉移性NSCLC 患者的一線治療。23的批准是激酶抑制劑開發的一個里程碑,因為它是第一個不可逆的EGF家族抑制劑被批准作為EGFR突變的NSCLC患者的一線治療。
達拉非尼 (24)
由葛蘭素史克 (GSK2118436) 開發並以 Tafinlar 的商品名銷售,24於2013年獲得加速批准,用於治療攜帶 BRAF-V600E突變的不可切除或轉移性黑色素瘤患者,該突變可透過FDA批准的測試檢測到。2014年也獲批與曲美替尼聯合用藥,用於治療BRAF-V600E或BRAF-V600K突變的不可切除或轉移性黑色素瘤患者。這種聯合療法也被批准用於治療具有 BRAF-V600E 突變的轉移性 NSCLC 患者。24單獨和與26組合的臨床開發已在別處進行了審查。特別令人感興趣的是發現24對腦轉移的活性。
依魯替尼 (25)
最初由Celera Genomics (PCI-32765) 開發作為靶向 Burton 酪氨酸激酶 (BTK) 的工具化合物, 25被 Pharmacyclics 收購以開發其臨床專案,現在以Imbruvica 的名稱銷售。化合物25於2013年獲得 FDA 的加速批准,用於治療已接受過至少一種先前治療的成人套細胞淋巴瘤 (MCL) 患者。此後,FDA 還於2014年批准了治療慢性淋巴細胞白血病 (CLL)、2015年瓦爾登斯特倫巨球蛋白血癥 (WM) 和2017年慢性移植物抗宿主病 (cGVHD) 和加速批准邊緣區域淋巴瘤 (MZL)。
曲美替尼 (26)
由日本菸草公司發現,葛蘭素史克公司 (GSK1120212) 開發並以 Mekinist 商品名上市,26於2013年獲得 FDA 批准用於治療具有 BRAF-V600E 或 BRAF-V600K 突變的不可切除或轉移性黑色素瘤患者,如透過 FDA 批准的測試檢測到,之前沒有治療。26 單獨或與24組合的臨床開發是為數不多的幾個例子之一,其中聯合療法與單一療法相比呈現出有利的不良事件特徵。基於這些發現,FDA 於2014年批准了26與24種聯合治療,並傾向於聯合治療而不是僅使用26的單藥治療。
色瑞替尼 (27)
由諾華 (LDK378) 開發並以 Zykadia 上市銷售的藥物27於2014年獲得加速批准,作為疾病已進展或腫瘤已對克唑替尼 (13)耐藥的ALK陽性轉移性NSCLC患者的二線治療藥物。2017年,色瑞替尼獲得批准作為腫瘤為 ALK 陽性的轉移性 NSCLC 患者的一線治療。
Idelalisib (28)
Idelalisib (28)是Icos發現的,由 Calistoga Pharmaceuticals (CAL-101) 和 Gilead Sciences (GS-1101) 開發,並以 Zydelig 銷售的藥物,28是透過探索用於生成磷酸肌醇3的 4-quinazolin-4-one骨架而發現的-激酶(PI3K)抑制劑。2014年,FDA 批准了28與利妥昔單抗聯合用於治療複發性CLL患者。此外,28獲得加速批准,用於治療既往接受過至少兩種全身治療的複發性濾泡B細胞非霍奇金淋巴瘤和複發性小淋巴細胞淋巴瘤。化合物28成為第一個上市的選擇性PI3K抑制劑。
尼達尼布 (29)
由勃林格殷格翰 (BIBF1120) 開發並以Ofev和Vargatef上市。根據適應症,29 分別於2014年和2015年分別獲得FDA和EMA的批准,用於治療特發性肺纖維化 (IPF),並以Ofev上市。2014 年,EMA還批准了名為 Vargatef 的29與多西紫杉醇聯合治療患有區域性晚期、轉移性或區域性複發性腺癌組織學的非小細胞肺癌成年患者,作為二線化療。就非小細胞肺癌而言,29人在I期和II期試驗中證明了有效性和安全性,並在III期LUME-Lung 1研究中與多西他賽聯合使用時顯示出顯著益處。迄今為止,FDA尚未批准使用29來治療腫瘤疾病。
艾樂替尼 (30)
由Chugai (CH/RO5424802)開發並由 Hoffmann-La Roche/Genentech進一步推進,30以Alecensa的名稱銷售。 2015年30被批准用於治療進展或對克唑替尼 (13)耐藥的晚期ALK陽性NSCLC患者。2017年,艾樂替尼 (30)被獲批用於晚期ALK陽性NSCLC患者的一線治療。
考比替尼 (31)
31由 Exelixis(GDC-0973,XL518)發現,是與基因泰克(羅氏集團)合作開發的,並以Cotellic的商品名銷售。 coBRIM 3期試驗將31加BRAF抑制劑16與安慰劑加16進行比較,結果支援FDA及瑞士治療產品署 (Swissmedic)於2015年批准該組合用於治療具有 BRAF-V600E 或 BRAF-V600K 突變的不可切除或轉移性黑色素瘤患者。
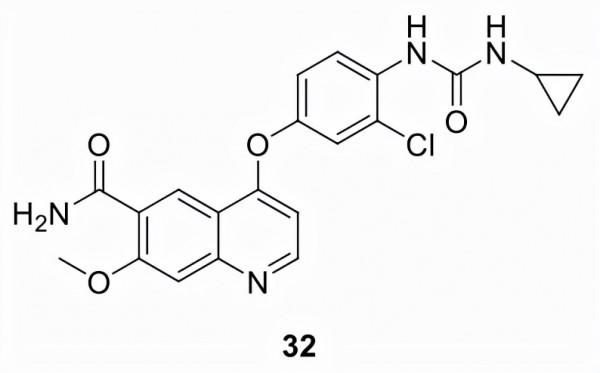
樂伐替尼 (32)
由衛材公司 (E7080) 開發並以 Lenvima 銷售的32最初於2015年獲得FDA批准,用於治療區域性復發或轉移性、進展性、放射性碘難治性分化型甲狀腺癌 (DTC) 患者。FDA已批准在另外兩個適應症中使用32。 2016年,它被批准與11聯合治療,用於治療先前接受過抗血管生成治療後的晚期 RCC 患者, 2018年,在III期試驗REFLECT 的基礎上,它被批准用作不可切除HCC患者的一線治療。
奧希替尼 (33)
由阿斯利康 (AZD-9291) 開發並以 Tagrisso 銷售的33於2015年獲得批准,作為晚期EGFR-T790M突變陽性NSCLC患者的二線治療選擇。 2018年,33獲得進一步批准,作為腫瘤具有 EGFR 外顯子19缺失或外顯子 21 L858R 突變的轉移性 NSCLC 患者的一線治療藥物。最近,在2020年,奧希替尼 (33)獲得批准,可用於腫瘤具有EGFR外顯子19缺失或外顯子21 L858R突變的NSCLC 患者的腫瘤切除術後輔助治療。
帕博西尼 (34)
由輝瑞 (PD0332991) 開發,旨在透過選擇性細胞週期蛋白依賴性激酶 (CDK) 4 抑制劑實現有效的腫瘤生長抑制,34在2015年獲得 FDA 加速批准後以 Ibrance 的名稱銷售,用於與來曲唑用於治療絕經後婦女的激素受體 (HR) 陽性、HER2 陰性晚期或轉移性乳腺癌。2017年,帕博西尼 (34)另外兩種聯合療法獲得常規批准:帕博西尼 (34)聯合芳香酶抑制劑作為初始內分泌療法,或聯合抗雌激素氟維司群用於內分泌治療後疾病進展的患者。
4. 2016-2020年FDA批准的激酶抑制劑
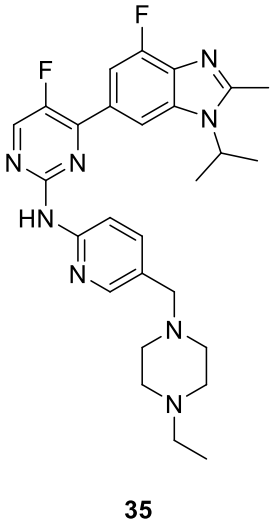
Abemaciclib (35)
Eli Lilly (LY2835219) 透過對靶向 CDK4/6 的 2-(pyridin-2-ylamino)pyrido[2,3-d]pyrimidin-7-ones 系列的先導最佳化發現。化合物35於2017年獲得FDA批准後作為Verzenio上市銷售,用於與芳香酶抑制劑或氟維司群聯合治療晚期或轉移性 HR 陽性、HER2 陰性乳腺癌。
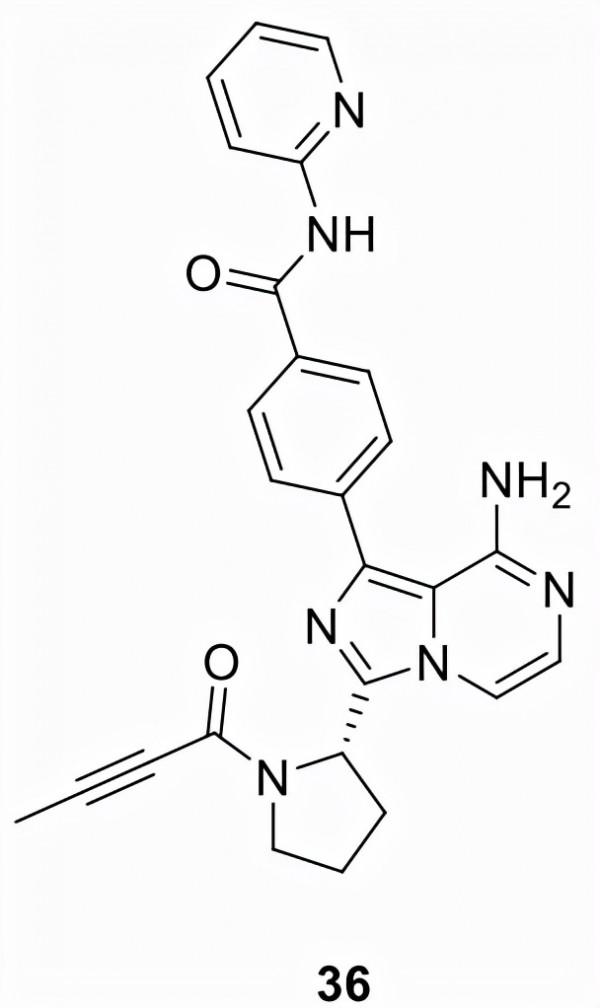
阿卡拉布替尼 (36)
由Acerta Pharma (ACP-196) 開發,後來被阿斯利康收購,並於2017年以 Calquence的名稱上市,36獲得FDA的加速批准,用於治療成人套細胞淋巴瘤 (MCL) 患者。然後,在2019年,36獲得了用於治療成人 CLL和小淋巴細胞淋巴瘤(SLL)患者的全面批准。
布加替尼 (37)
由武田製藥的全資子公司 ARIAD Pharmaceuticals (AP26113) 開發,37的銷售名稱為 Alunbrig。2017年,37獲得加速批准,用於治療腫瘤已經進展或對13耐藥的ALK陽性轉移性非小細胞肺癌患者。2020年,37獲批作為ALK陽性轉移性非小細胞肺癌的一線治療藥物。
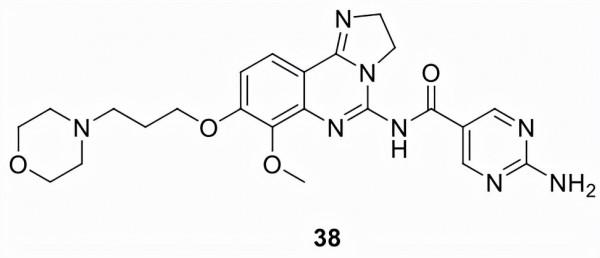
Copanlisib (38)
由拜耳 (BAY 80-6946) 發現和開發,並於2017 年以Aliqopa的名稱上市,FDA 授予了38加速批准,用於治療已接受過至少兩種既往全身治療的複發性濾泡性淋巴瘤成人患者。
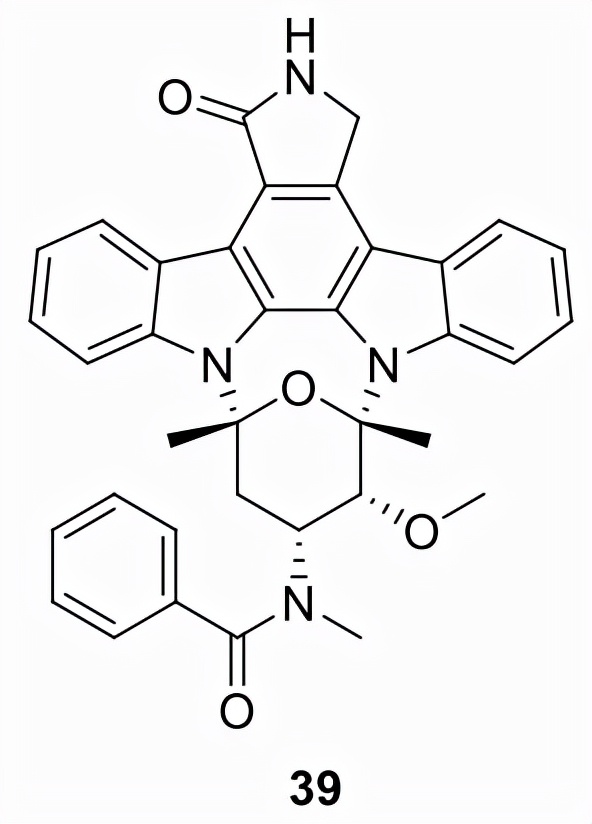
米多林 (39)
由諾華製藥公司 (PKC-412, CGP41251) 開發並於201年批准用於治療新診斷的 FLT3突變陽性的AML,經FDA批准的測試(LeukoStrat CDx FLT3 Mutation Assay)檢測,39被批准用於三種聯合療法:阿糖胞苷、柔紅黴素作為誘導療法、阿糖胞苷作為鞏固療法。同年,39獲批用於治療侵襲性系統性肥大細胞增多症、系統性肥大細胞增多症伴相關血液腫瘤或肥大細胞白血病。
來那替尼 (40)
由惠氏 (Wyeth) 開發,目前由彪馬生物技術 (HKI-272) 進一步開發,並以 Nerlynx 銷售,40於2017年獲得批准,用於延長輔助治療早期HER2過度表達或擴增的乳腺癌患者之前接受過基於曲妥珠單抗的輔助治療。 2020年,批准擴大到包括40與卡培他濱聯合用於治療晚期或轉移性HER2陽性乳腺癌患者,這些患者在轉移性環境中接受過至少兩種先前的基於抗HER2的方案。
奈達舒地爾 (41)
由 Aerie Pharmaceuticals (AR-13324) 開發並以 Rhopressa 銷售,41是在一個專注於開發具有持久降眼壓作用的 ROCK 抑制劑的專案中發現的,該抑制劑允許每天給藥一次。2017 年,FDA 批准41作為開角型青光眼或高眼壓症患者的眼藥水。
Ribociclib (42)
由諾華 (LEE011) 在一項藥物化學工作中開發,旨在產生具有 CDK4/6 抑制活性的新型吡咯並嘧啶化合物用於治療癌症,42自2017年以來已作為 Kisqali 上市。它已獲得 FDA 批准用於治療HR 陽性、HER2 陰性晚期或轉移性乳腺癌聯合芳香酶抑制劑治療絕經後婦女。
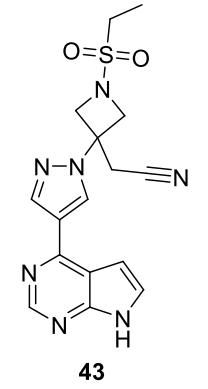
巴瑞替尼 (43)
由 Incyte Corp. (INCB028050) 發現,由禮來 (Eli Lilly) 許可開發並以 Olumiant 銷售,(344)43 於 2018 年獲得 FDA 批准,用於治療反應不足的中度至重度活動性類風溼性關節炎成年患者一種或多種腫瘤壞死因子 (TNF) 拮抗劑療法。
比美替尼 (44)
由Array BioPharma開發(MEK162,ARRY-438162)並於2010年授權給諾華,隨後在2015年,Array BioPharma 重新獲得全球權利,並以 Mektovi 的商品名與 encorafenib 聯合開發了44。如今,在2019年收購Array Biopharma後,兩者都被納入輝瑞的產品組合。 44和47的組合於2018年6月獲得FDA批准,用於治療FDA檢測到的具有 BRAF-V600E 或 BRAF-V600K 突變的不可切除或轉移性黑色素瘤- 批准的測試。44和47的臨床開發成功使該組合在2013年獲得孤兒藥地位。
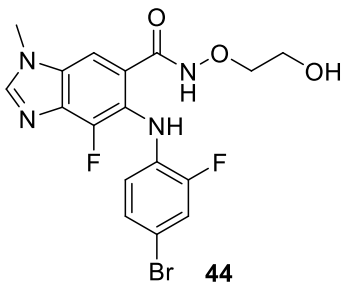
達克替尼 (45)
由輝瑞 (PF-299804) 開發並以 Vizimpro 銷售的45於2018年獲得批准,用於一線治療具有 EGFR 外顯子19缺失或外顯子 21 L858R 替換突變的晚期 NSCLC 患者。
Duvelisib (46)
由 Intoplicine(INK1197) 發現,該公司於2012年被 Millennium Pharmaceuticals 收購,在尋找調節 PI3K 活性的新分子時,46被授權給 Infinity Pharmaceuticals (IPI-145)。隨後,Verastem Oncology 在2016年獲得了全球獨家權利,以 Copiktra 為商標開發和商業化46。 FDA於2018 年授予46批准,用於治療接受至少兩種既往全身治療的複發性或難治性 CLL、小淋巴細胞淋巴瘤(SLL)和濾泡性淋巴瘤(FL)成年患者。
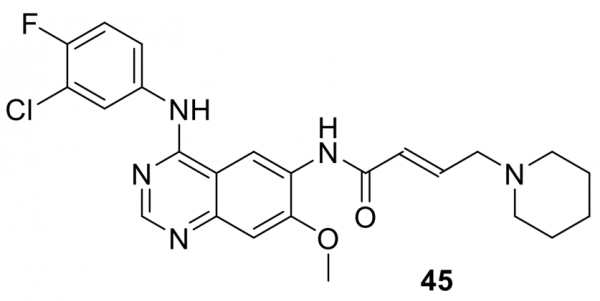
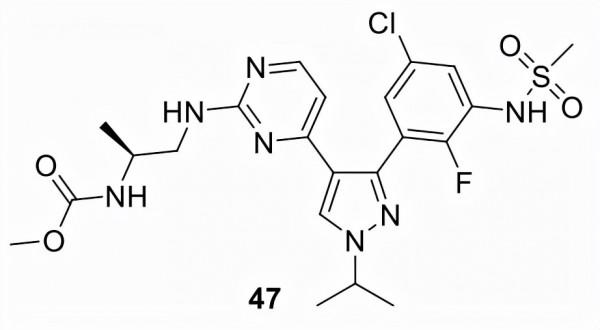
恩科拉非尼 (47)
由諾華髮現,Array BioPharma於2015年接管了47(LGX818)和44的開發。2019年收購Array Biopharma後,它屬於輝瑞的投資組合,並以Braftovi銷售。如上所述,47和44的組合在2018年獲得 FDA 批准,用於治療由 FDA 批准的測試檢測到的具有BRAF-V600E 或 BRAF-V600K 突變的不可切除或轉移性黑色素瘤。2020年,FDA批准47與西妥昔單抗聯合用於既往治療後BRAF-V600E突變轉移性CRC的治療。
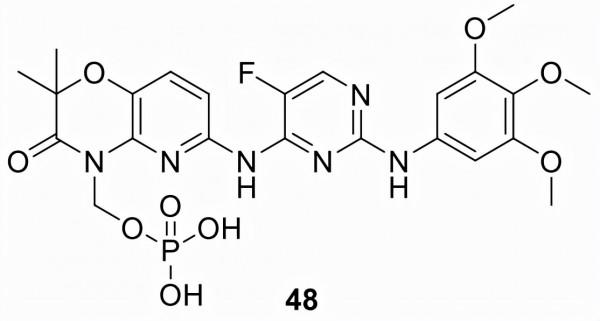
福斯塔替尼 (48)
由 Rigel Pharmaceuticals (R788) 開發並以 Tavalisse 銷售的48於2018年被批准用於治療對先前治療反應不足的成年患者的慢性免疫性血小板減少症。
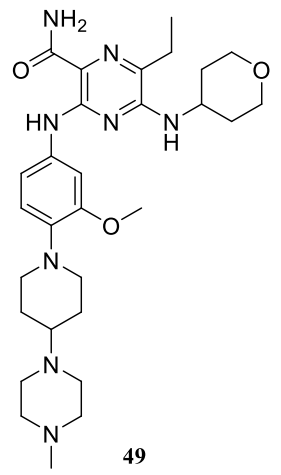
吉爾特替尼 (49)
透過Astellas Pharma (ASP-2215) 和 Kotobuki Pharmaceutical 之間的研究合作發現,49由Astellas Pharma臨床開發並以Xospata銷售。2018年,49首次在日本獲得批准,隨後被FDA批准用於治療具有FLT3致癌突變的復發或難治性 AML 成人患者。
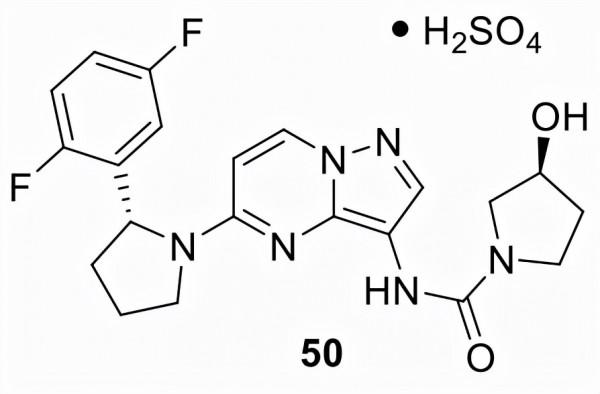
拉羅替尼 (50)
由Array BioPharma (ARRY-470) 發現,並由Loxo Oncology 和 Bayer AG (LOXO-101) 進一步共同開發,50 以 Vitrakvi的名稱銷售,於2018年獲得初步批准。化合物50於 2018 年獲得 FDA 加速批准用於成人和患有神經營養受體酪氨酸激酶 (NTRK) 基因融合的實體瘤兒童患者,沒有已知的獲得性耐藥突變,轉移性或手術切除可能導致嚴重的發病率,並且沒有令人滿意的替代治療或治療後復發,無論腫瘤的器官、組織或位置如何。化合物50是第一個被 FDA 指定為組織不可知突破性療法的小分子。透過基於結構的藥物發現方法發現了化合物50。
勞拉替尼 (51)
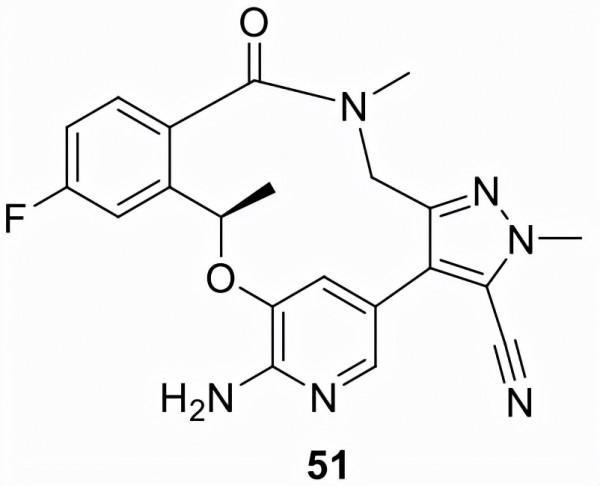
由輝瑞 (PF-06463922) 開發並以 Lorbrena 銷售的51於2018年獲得加速批准,作為ALK陽性轉移性非小細胞肺癌患者的二線或三線治療藥物,這些患者的腫瘤已經復發並對現有治療產生耐藥性。2021年,批准擴大到 ALK 陽性轉移性 NSCLC 患者的一線治療。化合物51旨在穿透血腦屏障以提高對複發性肺癌患者常見腦轉移的治療效果。
Alpelisib (52)
由諾華 (NVP-BYL719) 在一項旨在產生選擇性 PI3Kα 抑制劑的研究計劃中開發並以 Piqray 銷售,(403-405)52 於2019年被FDA批准與氟維司群聯合用於治療HR陽性患者,先前接受過內分泌治療的HER2陰性、PIK3CA突變的晚期或轉移性乳腺癌。
恩曲替尼 (53)
53由 Nerviano Medical Sciences 開發,目前由羅氏 (RXDX-101) 商業化,並作為 Rozlytrek 銷售。化合物53於2019年獲得加速批准,用於治療具有神經營養性酪氨酸受體激酶 (NTRK) 基因融合但無已知耐藥突變或轉移性或可能手術切除的實體瘤成人和兒童患者(≥12 歲)導致嚴重的發病率,並且在治療後復發或沒有令人滿意的標準療法。此外,53 被批准用於治療腫瘤為ROS1陽性的轉移性 NSCLC 成人。透過高通量篩選和命中最佳化活動發現了化合物53。
厄達替尼 (54)
由 Janssen Pharmaceutical Cos. (JNJ-42756493) 與 Astex Pharmaceuticals 合作開發並以 Balversa 銷售,54於2019年獲得加速批准,用於治療晚期或轉移性尿路上皮癌患者,具有易感的 FGFR 基因改變,這些患者在或化療後。關鍵的基因改變包括 FGFR3 基因突變,或 FGFR2 或 FGFR3 基因融合。
費德拉替尼 (55)
費德拉替尼 (55)由TargeGen (TG101348) 開發,採用基於結構的藥物設計,旨在產生選擇性 JAK2 抑制劑,並以 Inrebic 的名義上市, 55於2019年獲得 FDA 的批准。
Pexidartinib (56)
由Daiichi Sankyo Inc. (PLX3397) 開發和商業化,商品名為 Turalio,56於2019 年8月獲得 FDA 批准作為一線治療患有症狀性腱鞘鉅細胞瘤 (TGCT) 的成人患者功能受限且無法透過手術改善。
優帕替尼 (57)
由Abbvie (ABT-494) 在旨在生成選擇性 JAK1 抑制劑以克服與第一代 JAK 抑制劑22和43相關的耐受性問題的計劃中開發,並以 Rinvoq 銷售。化合物 57於 2019 年獲得 FDA 批准用於治療成人對甲氨蝶呤反應不足或不耐受的中重度活動性類風溼性關節炎。
澤布替尼 (58)
由百濟神州 (BCB-3111) 發現,旨在開發脫靶效應低於25的選擇性 BTK 抑制劑,目前以 Brukinsa上市,58於2019年獲得 FDA 的加速批准,用於治療成年 MCL患者之前接受過至少一種治療的人。
Avapritinib (59)
由 Blueprint Medicines (BLU-285) 開發並以 Ayvakit 銷售的 59 種藥物於 2020 年獲得批准,用於治療攜帶 PDGFRA 外顯子 18 突變的不可切除或轉移性 GIST 成人,包括最常見的 PDGFRA-D842V 突變。化合物 59 獲得了多項特定的 FDA 指定,包括突破性療法、孤兒藥狀態和快速通道。
卡馬替尼 (60)
由諾華在 Incyte Corp. (INC280, INCB 28060) 許可下開發並以 Trabecta 銷售的 60 在 2020 年獲得加速批准,用於治療成人轉移性非小細胞肺癌患者。批准專門針對具有導致間充質 - 上皮轉化 (MET) 外顯子 14 跳躍的突變的腫瘤,該突變可透過 FDA 批准的診斷測試檢測到。化合物60是 FDA 批准的第一種治療具有這種特定突變的 NSCLC 的療法。
培米加替尼 (61)
由 Incyte Corp. (INCB054828) 在專注於開發對 FGFR 酶具有抑制活性的三環尿素化合物的專案中發現,目前以 Pemazyre 銷售,化合物61於2020年獲得 FDA 的加速批准,用於治療成人患者具有 FGFR2 融合或其他重排的先前治療過的、不可切除的區域性晚期或轉移性膽管癌。
普拉賽替尼 (62)
由 Blueprint Medicines (BLU-667) 開發並以 Gavreto 銷售的62在2020年獲得加速批准,用於治療轉移性 RET 融合陽性 NSCLC 患者。同年晚些時候,62還被批准用於治療需要全身治療的晚期或轉移性 RET 突變甲狀腺髓樣癌或需要全身治療且對放射性碘耐藥的RET融合陽性甲狀腺癌患者。
利普替尼 (63)
由Deciphera Pharmaceuticals (DCC-2618) 在旨在產生突變 KIT 和 PFGFRA 激酶抑制劑的藥物化學活動中開發,並以 Qinlock 銷售,63於2020年獲得 FDA 批准用於治療成人晚期 GIST 患者既往接受過三種或更多種激酶抑制劑治療的患者,包括伊馬替尼 (2)。
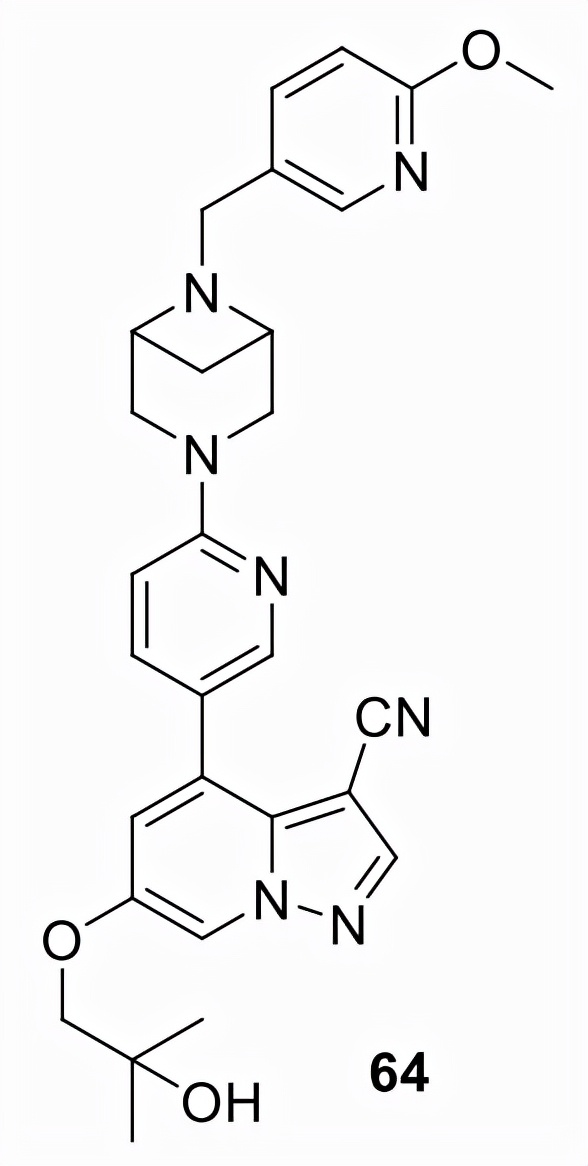
Selpercatinib (64)
Array BioPharma (ARRY-192) 在專注於生成作為 RET 激酶抑制劑的吡唑並[1,5-a] 吡啶類似物的藥物化學活動中發現,64由 Loxo Oncology (LOXO-292) 和由禮來 (Eli Lilly) 銷售為 Retevmo。2020年,FDA授予64項加速批准用於治療成人轉移性RET融合陽性NSCLC患者,用於治療需要全身治療的12歲及以上晚期或轉移性RET突變型MTC成人和兒童患者,用於治療需要全身治療且放射性碘難治的晚期 RET 融合陽性甲狀腺癌。
司美替尼 (65)
由 Array BioPharma 開發並授權給阿斯利康 (AZD-6244, ARRY-142886),該藥物以Koselugo的名義銷售。化合物65於2020年獲得批准,用於治療2歲及以上患有 1 型神經纖維瘤病 (NF1) 的有症狀、無法手術的叢狀神經纖維瘤 (PN) 的兒科患者。 NF1 基因編碼神經纖維蛋白,其下調 RAS/MAPK 通路。然而,NF1 的突變基因產物失活,導致 RAS/RAF/MEK/ERK 訊號失調,從而使細胞不受控制地生長。
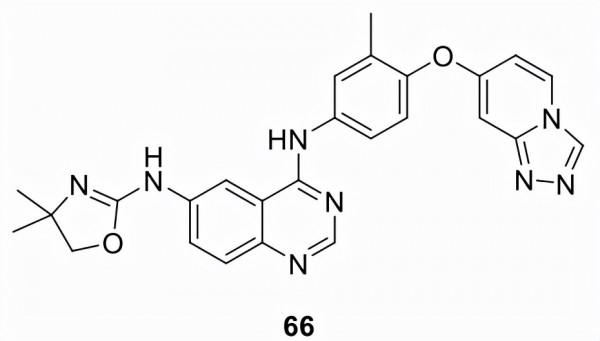
圖卡替尼 (66)
由Array BioPharma Inc. (ONT-380, ARRY-380) 發現並以 Tukysa 銷售,66於2020年獲得 FDA 批准與曲妥珠單抗和卡培他濱聯合用於治療晚期不可切除或轉移性 HER2陽性成人患者乳腺癌,包括腦轉移患者,在轉移性環境中曾接受過一種或多種基於抗 HER2 的方案。
截至2020年底,除了FDA批准的65種激酶抑制劑藥物外,許多激酶抑制劑已獲得其他機構的監管批准,包括EMA(歐洲)和日本的藥品和醫療器械管理局(PMDA)。
參考文獻:https://doi.org/10.1021/acs.jmedchem.1c00963