有業內人士指出,21 世紀當屬細胞治療的時代。截止目前, 全球共有 2073 項細胞療法在研、358 項臨床試驗正在進行中,6 款 CAR-T 療法已獲批,基於 iPS 的幹細胞療法發展勢頭迅猛...
國內細胞療法賽道同樣熱鬧非凡,一方面授權引進的兩款 CAR-T 已經相繼在國內獲批實現商業化,另一方面自研 CAR-T 也進展頻頻,有望在未來幾年內獲批上市。
近日,國內細胞療法公司西比曼生物(Cellular Biomedicine Group)宣佈 FDA 批准其核心管線雙靶點 CAR-T 細胞療法 C-CAR039 的 IND 申請,即將在美國開展臨床研究。
根據官方介紹,這是西比曼生物自研的一款針對 CD19/CD20 的雙靶點 CAR-T 細胞療法,用於治療復發或難治性 B 細胞非霍奇金淋巴瘤,具有成為同類最佳(BIC)的潛力。此前,其這款 CAR-T 細胞療法用於治療濾泡性淋巴瘤(FL)還獲得了 FDA 的孤兒藥資格認定。
藉此機會,生輝與西比曼生物董事長兼執行長劉必佐先生聊了聊西比曼生物當前的進展以及未來的規劃。

圖 | 西比曼生物董事長兼執行長劉必佐先生(來源:受訪者提供)
劉必佐管理經驗豐富,曾在美國微軟公司任職近 20 年,主要負責微軟在中國的投資戰略和公司戰略規劃,此前還在阿里巴巴等擔任投資和財務相關管理負責人。他於 2014 年正式加入西比曼生物,在該公司發展過程中扮演了重要的角色,從主導西比曼生物在納斯達克上市,推進免疫細胞療法和幹細胞療法進展,到完成私有化交易並正式從美股迴歸,再到完成 1.2 億美元 A 輪融資...
“2022 年會是西比曼生物收穫的一年,同時也將是我們具有跳躍性的一年。一方面,獲得阿斯利康和諾華的認可,這對於我們的質量管理體系、科學和生產工藝的提升至關重要;另一方面,免疫細胞療法和幹細胞藥物正在同時並行推進,預計今年至少有兩款產品在美國進入註冊臨床試驗階段,在中國有四款產品可能會進入關鍵性臨床試驗階段,涵蓋針對關節炎的幹細胞藥物到血液瘤和實體瘤的 CAR-T 細胞療法。” 劉必佐告訴生輝。
“透過私有化打通人才、技術和資金”
對於西比曼生物來說,2021 年是非同尋常的一年。
指標回撥到 2014 年,成立約 5 年的西比曼生物成功登陸納斯達克,成為 “中國細胞療法第一股”。後續,西比曼生物與諾華達成合作,負責諾華已上市產品 Kymriah 在中國的生產和製造。
時隔 7 年之後,西比曼生物決定從美股迴歸,並於同年 2 月正式完成私有化交易。私有化指由上市公司大股東作為收購建議者所發動的收購活動,透過全數買回小股東手上的股份,買回後上市公司會轉變為私有公司,即完成退市。
緊接著, 9 月,該公司官宣完成阿斯利康中金醫療產業基金、紅杉資本和雲鋒基金共同領投的 1.2 億美元 A 輪融資。至此,西比曼生物也成為國內同時獲得阿斯利康和諾華認可的細胞療法公司。
“生物醫藥領域是一個需要長期投入的過程,在這個過程中有幾個關鍵的迴圈點,一是人才、二是技術、三是資金。這三個點相輔相成、相互關聯,缺一不可。在這個時間節點,我們希望透過私有化打通這三個環節,為公司發展帶來新動力。” 劉必佐坦言。
據劉必佐介紹,透過私有化最佳化調整了股東結構,透過持股等措施讓更多員工參與到管理中,這些對於公司的長期穩定發展至關重要。
據悉,私有化對於產品多元化和產品定位也有一定的幫助。完成私有化之後,我們的產品定位會聚焦於從血液瘤到實體瘤、從臨床前到臨床、幹細胞藥物和免疫治療並行等。
預計未來 3 年內幹細胞藥物實現商業化
劉必佐告訴生輝,今年,多款免疫細胞療法和幹細胞藥物將迎來重要進展。
在此之前,有必要先介紹一下西比曼生物的整體管線佈局策略。官網顯示,西比曼生物有兩大技術平臺,分別為腫瘤免疫平臺和幹細胞平臺,並基於專有的平臺,衍生出多條在研管線。
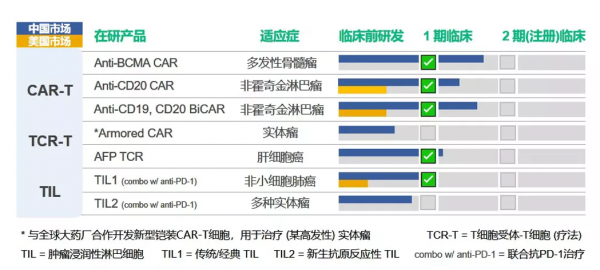
“從細胞免疫療法來看,我們透過自研雙靶點 CAR-T 以及與諾華合作佈局血液瘤,針對實體瘤佈局了 TIL 細胞療法;從幹細胞藥物來看,我們佈局了自體和同種異體的兩種型別幹細胞療法,其中自體管線處於臨床 II 期階段。” 劉必佐說。
據劉必佐介紹,上文提到的 CD19/CD20 CAR-T 是針對血液瘤的核心產品之一,最新的臨床資料顯示,其針對 B 細胞非霍奇金淋巴瘤的總緩解率為 92.6%,完全緩解率 85.2%。目前,該療法也已獲美國的 IND 批件。
據悉,實體瘤也是其重點佈局方向,目前該公司佈局了兩條 TIL 在研管線,其中針對非小細胞肺癌的 TIL 療法預計 2022 年申報 IND。TIL(腫瘤浸潤淋巴細胞)是近年來極具前景的一種過繼性細胞療法,由靶向癌細胞中多種抗原的 T 細胞組成。因此,與 CAR-T 或 TCR-T 相比,TIL 療法可以透過靶向多個癌細胞靶點引發細胞毒性反應,其已在多種實體瘤中表現出了出色的臨床治療效果。
幹細胞藥物是西比曼生物進展最快的管線,自體幹細胞去年底會完成臨床 II 期隨訪,預計今年第一季度會公佈資料。 “針對膝骨關節炎的自體幹細胞藥物在國內處於前列,預計今年進入臨床 III 期研究,有望成為國內同行業內第一批‘吃螃蟹的人’。” 劉必佐說。
骨關節炎是關節炎最常見的形式,其中膝骨關節炎 (knee osteoarthritis,KOA) 在臨床上最為常見。這是一種慢性退行性骨關節疾病,常常表現為關節軟骨的退行性變和繼發性骨質增生。我國中老年人群中症狀性 KOA 的患病率為 8.1%,且有不斷升高的趨勢。目前,臨床治療方法主要以緩解改善關節功能為主,尚無有效療法。憑藉免疫調節和損傷修復特性等特點,間充質幹細胞藥物為 KOA 治療帶來一種新療法。
據悉,商業化佈局也已經展開,目前在張江已經擁有 1 萬平 GMP 生產基地,無錫也有生產基地,產能加起來可以滿足未來西比曼生物幹細胞藥物商業化產能。
“未來 3-5 年國內自研細胞療法將陸續走向商業化”
腫瘤細胞免疫治療也被視為繼手術、放療和化療之後的第四種腫瘤治療方法,其中以 CAR-T 療法發展最為成熟,當前全球已有 6 款 CAR-T 獲批上市,市場發展前景良好。
根據弗若斯特沙利文的資料,預計 2030 年全球 CAR-T 細胞治療市場規模約為 218 億美元。視線轉回中國市場,2024-2030 年,中國 CAR-T 市場規模將從 53 億元增長至 289 億元,年複合年增長率為 32.6%。

(來源:UT Southwestern Medical Center)
“全球細胞療法欣欣向榮,我非常看好中國細胞療法的發展前景,同時也對幹細胞藥物治療持樂觀態度。未來 CAR-T 等細胞療法在治療血液瘤和實體瘤領域的應用潛力將會得到進一步驗證,幹細胞藥物也將迎商業化。” 劉必佐對細胞治療信心滿滿。
劉必佐指出,整體來看,國內細胞治療的研發進展大體可以分為 3 個階段,2016 年是該領域的一個重要分水嶺。2016 年之前,國內細胞療法處於自由發展階段;2016 年,在‘魏則西事件’的警醒下,該行業進入調整和規範階段;2016 年至今,國內細胞治療處於規範化、科學化的高速發展期。
2021 年也被稱為中國 CAR-T 細胞療法商業化元年。一方面,兩款海外引進產品相繼獲批上市,國內 CAR-T 細胞療法開啟商業化程序;另一方面,國內眾多細胞治療公司的產品也已相繼申報 IND 或者已進入臨床 I 期。
國內自研產品何時可以實現商業化?
劉必佐指出,細胞治療產品與普通創新藥物的關鍵區別之一是 CMC 環節:只有掌握先進的生產製造工藝,完善配套的 QA/QC 流程輔助,才能達到監管機構對於細胞治療產品上市申請的要求,同時還要實現成本和生產時間可控。
“我們相信隨著中國整體細胞治療技術的提高,國內細胞療法公司會開發出更多有效性、安全性更佳的細胞治療產品。同時,細胞療法的相關生產設施及配套管理流程也會越來越符合全球監管機構標準。預計,未來 3-5 年內國內自研細胞療法會相繼走向商業化。” 劉必佐總結道。
對於西比曼生物的下一步發展,劉必佐胸有成竹。“我們的下一步規劃可以分為兩個方面,一是研發和臨床開發,二是商業化。在研發和臨床上,實體瘤是我們細胞治療的重點攻克領域,基於 TIL 和 Armored CAR 兩大技術平臺,計劃在中美開展多個針對實體瘤的臨床試驗;加速自研血液瘤細胞治療產品的上市申報程序,與諾華合作加快 Kymirah 在中國的商業化。”