中科院上藥所鄭明月研究員團隊利用深度生成模型、激酶選擇性篩選等計算手段,設計了一種新型DDR1抑制劑,該化合物能有效抗炎,在DSS誘導的小鼠結腸炎模型中顯示出良好的口服治療效果。
背景介紹
阻斷細胞因子是臨床上常用的炎症性腸病 (IBD)標準療法。突變的盤狀結構域受體1(DDR1)會導致炎症細胞因子過度分泌,是IBD的重要靶點。目前已知的 DDR1抑制劑,具有靶點特異性差的缺陷。在本研究中,作者透過分子設計流程發現了候選的DDR1先導化合物。分子設計流程包括以下三個步驟:使用匹配分子對 (MMP) 演算法獲得片段庫,訓練生成模型並生成一個基於骨架的虛擬分子庫,最後經過分子庫虛擬分析和分子對接篩選搜尋出先導化合物,如圖1所示。
圖1. DDR1的基於骨架的分子設計流程。圖片來源:JMC
主要內容
DC-1是良好的DDR1抑制劑骨架
在之前的研究中,作者發現了一個FGFR 抑制劑DC-1。作者比較DDR1與FGFR1的結合口袋(圖2A),發現DDR1的結合口袋在DC-1的苯基區域有更大的擴充套件空間。如圖2B所示,DC-1的噠嗪部分與DDR1鉸鏈區的殘基Asp702和Met704形成三個氫鍵,DC-1與DDR1晶體結構中的配體重疊良好。DC-1的N-苯基取代基到達DDR1環部分的溶劑暴露區域。這些結果表明 DC-1有望被改造為有效 的DDR1 抑制劑。
圖2. DC-1在FGFR1和DDR1中的結合構象與模式。圖片來源:JMC
使用生成模型修飾骨架
作者用MMP演算法窮舉,從訓練集中生成大規模的分子對集。在一對分子中,作者將滿足氫鍵供體、可旋轉鍵等要求的分子看做骨架,另一個則看做裝飾分子,並在骨架上標記裝飾基團的附著點。訓練時輸入帶有附著點的分子,輸出裝飾過的分子。這裡的生成模型採用注意力的編碼器-解碼器架構,編碼器由雙向迴圈神經網路組成,接受輸入向量,將兩個方向的隱藏狀態彙總到解碼器。如圖 3A所示。生成模型每次裝飾一個附著點,將生成的分子再輸入裝飾器模型。流程迴圈直到最後一個附著點被裝飾,如圖3B所示。
圖3. 生成模型的架構,以及生成的分子示例。圖片來源:JMC
DDR1化合物庫的生成
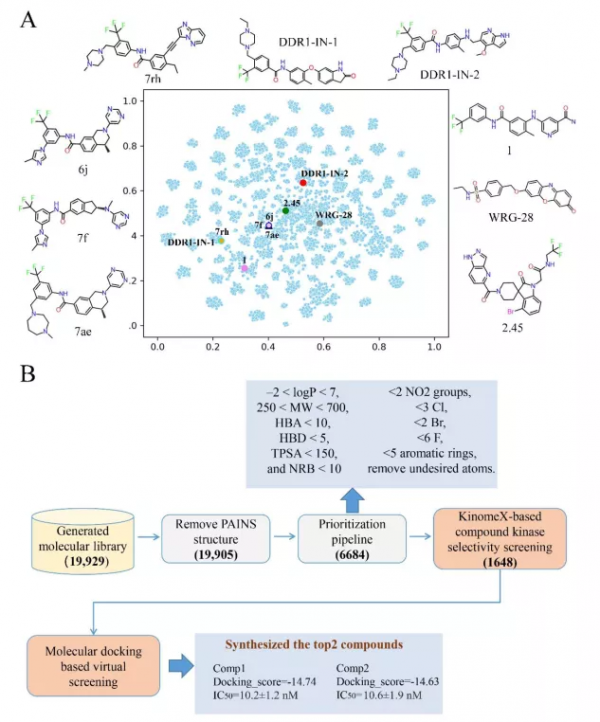
作者透過MMP演算法對902個DDR/FGFR抑制劑切片得到的36.03億個分子對訓練集,訓練模型生成了19929個分子。圖 4A 展示了生成的分子和 9 個已發表的選擇性 DDR 抑制劑的 t-SNE 結構多樣性分佈圖。相比於已知的 DDR1 選擇性抑制劑,生成的分子存在於更多樣化的化學空間中。
圖4. t-SNE視覺化生成的分子與已知的DDR1抑制劑的分佈;選取用於合成的分子的流程圖。圖片來源:JMC
虛擬篩選化合物發現先導化合物
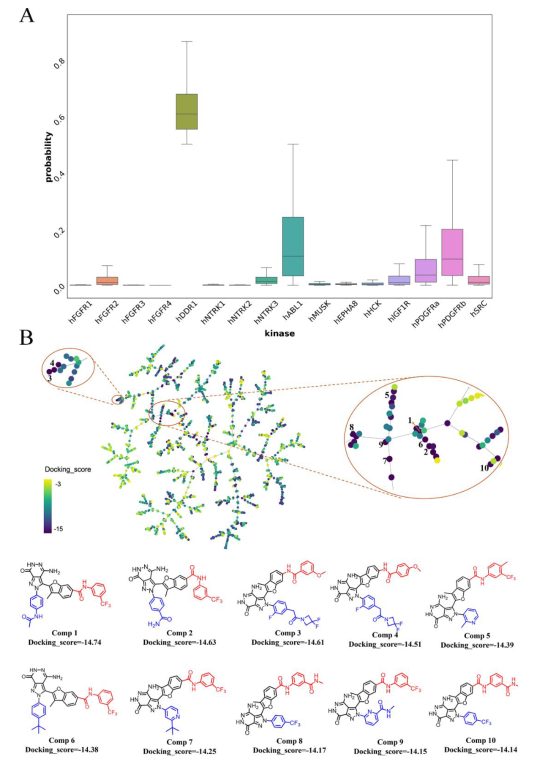
接下來,研究者對生成的分子進行虛擬篩選以發現更有效和有選擇性的 DDR1 抑制劑。流程如圖 4B所示。作者刪除了PAINS化合物,接著依據理化性質過濾一批分子,剩下了6684 個結構。KinomeX 是一個預測激酶抑制劑的全激酶組多藥理學效應的有效工具。為了提高激酶選擇性,作者保留了KinomeX顯示對 DDR1 顯示預測活性機率大於0.5 和對其他 15 種激酶顯示預測活性機率小於0.5 的生成分子。如圖 5A 所示,生成的分子對 DDR1 的預測活性機率顯著高於其他激酶。
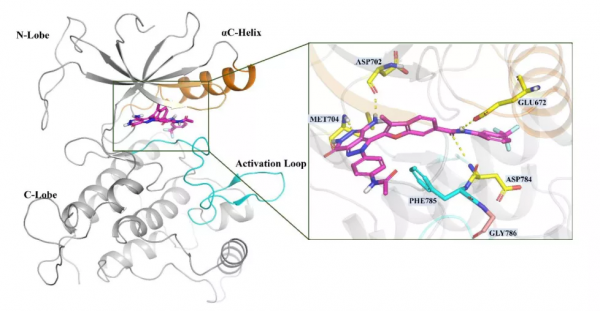
剩餘的 1648 種化合物透過 Glide 在 XP 模式下對接到晶體結構的配體位點。對接分數分佈圖表明,有 1540 種化合物的對接分數低於-6。為了視覺化結構相似性和對接分數之間的關係,繪製樹圖 (TMAP) 以建立最小生成樹的二維佈局,該樹根據相似性對分子進行聚類。圖 5B 顯示了剩餘 1648 個分子的 TMAP,其中分子及其相鄰分子具有密切的相似性值分別表示為樹的點和終端分支。每個分子的對接分數由點的亮度表示,顏色越深表示對接分數越低,即可能具有更高的結合親和力。結果表明,對接分數範圍從-3到-15,並且隨著分子結構特徵的變化而變化。由於分子結構的相似性,子樹的對接分數趨於一致。此外,作者還放大了TMAPs來說明前10個分子及其化學結構。結果表明,高分分子主要集中在兩個區域,其中一些結構非常相似並歸屬於同一子樹。其中,選擇前2種化合物合成(如Scheme 1所示)和生物活性實驗。化合物1和2對DDR1的IC50分別為10.2±1.2nM和10.6±1.9nM。化合物 2 以 Asp-Phe-Gly (DFG)-Asp-out 構象與 DDR1 結合,具有 II 型抑制機制(圖 6)。在鉸鏈結合區與Met704和Asp702形成了兩個氫鍵,c-Helix中的linker amide和Glu672與DFG基序中的Asp784之間形成了兩個額外的氫鍵。吡唑並[3,4-d]噠嗪酮骨架在鉸鏈結合區與 Met704 和 Asp702 形成兩個氫鍵,對維持活性有重要貢獻。同時,醯胺接頭與Glu672和Asp784形成了兩個額外的氫鍵。
圖5. KinomeX預測的分子的活性的分佈箱線圖。生成的分子的TMAP圖以及排名前10的分子。圖片來源:JMC
為了進一步評估 SAR,作者設計合成並測試了化合物 18-25,結果總結在表 1 中。酶促測定表明化合物的抑制活性降低,在 R2 位置變化不大(化合物 2 對化合物 18-21)。當 2 的 CF3 基團被去除或移到對位時,化合物 18 和19對 DDR1 的效力顯著降低。 用環己基 (20) 或正丁基 (21) 替換 CF3 取代的苯基也降低了活性。結果表明,2中的3-三氟甲基苯基基團可能與DFG-out構象形成的變構口袋深度結合,對於該化合物保持對DDR1的強抑制作用至關重要。根據上述 SAR 分析,作者設計併合成了 4 種新化合物(化合物 22-25)以闡述 R1 位置的 SAR。結果表明,R1位置的乙醯氨基苯基可以被苯基或取代苯基取代以保持強的DDR1抑制活性,IC50值範圍為27.4至60.4 nM。初步 SAR 研究表明,R2 位置的 3-三氟甲基苯基對於化合物保持對 DDR1 的強抑制作用至關重要。同時,發現R1位置對多種苯基取代基的耐受性良好。
圖6. 化合物2的結合模式。圖片來源:JMC
表1. 化合物18-25對DDR1的體外抑制活性。表格來源:JMC
化合物2的靶點特異性
為了進一步評估化合物 2 的一般激酶選擇性,作者評估了化合物 2 對一組 100 nM 的 430 種激酶的選擇性。確定了在固定濃度的 ATP (10 μM) 下這 430 種激酶磷酸化的抑制百分比。如圖7所示,那些抑制百分比>50%的激酶用紅色圓圈標記,圓圈的大小與抑制比例一致。值得注意的是,結果表明,與其他已發表的選擇性 DDR1 抑制劑相比,化合物 2 對 DDR1 表現出更高的選擇性。從 7rh 的激酶選擇性曲線來看,測試的 395 個非突變激酶中有 14 個顯示出明顯的結合(抑制率>65%)。化合物 6j 的IC50 值為 15.4 nM,在 BLM 誘導的小鼠肺纖維化模型中顯示出良好的效果,對TRKB 和 TRKC呈現脫靶效應,這表明化合物 2 具有突出的激酶選擇性。
圖7. 化合物2的激酶選擇性。圖片來源:JMC
化合物2抑制細胞中促炎細胞因子和DDR1自磷酸化的表達
鑑於 DDR1 在炎症反應中的重要功能,作者透過測量化合物 1 和 2 抑制LPS 誘導的促炎細胞因子(包括 IL-6、IL-1β 和 TNF)表達的能力來確定它們的潛在抗炎作用(圖8a)。結果表明,化合物 2 以 10 μM的活效能顯著抑制 LPS 誘導的促炎細胞因子在小鼠原代骨髓源巨噬細胞 (BMDM) 和人 THP-1 源巨噬細胞中的表達。此外,化合物 2 顯示出對 LPS 誘導的 IL-6 表達的劑量依賴性抑制。化合物 2 抑制細胞中 DDR1 自磷酸化,EC50 為 34.4 nM,比陽性對照 DDR1-IN-1 更有效。
圖8.化合物2(a)抑制細胞中促炎細胞因子和DDR1自磷酸化的表達的生物實驗結果(b) 改善dss誘導的小鼠結腸炎。圖片來源:JMC
化合物2改善DSS誘導的小鼠結腸炎
作者在 DSS 誘導的 IBD 小鼠模型中進一步研究了化合物 2 的治療潛力(圖8b)。在化合物2處理的小鼠中,在施用DSS後第5天至第8天體重顯著減輕;一致地,在化合物2處理的小鼠中糞便潛血評分降低。DSS 處理導致小鼠結腸長度顯著減少,這透過化合物 2 處理得到顯著改善。組織學評估顯示模型小鼠第 9 天結腸切片炎症細胞浸潤、上皮嚴重破壞和隱窩丟失,而在複合 2 處理的模型小鼠中,這些特徵得到改善,並且急性結腸炎的組織學評分顯著降低。因此,模型小鼠結腸切片中 IL-6、IL-1β 和 TNF 的表達明顯增加,但在化合物 2 處理的模型小鼠中要低得多。類似地,血清中 IL-6、IL-1β 和 TNF 的濃度在模型小鼠中增加,但在化合物 2 處理的模型小鼠中也低得多。綜上所述,這些結果表明,化合物 2 的給藥在體內對 DSS 誘導的 IBD 產生了明顯的治療保護效應。
總結
本文介紹了一個基於骨架的用於開發潛在的 DDR1 候選藥物的分子設計工作流程。對FGFR 抑制劑骨架建立了深度生成模型,而後對生成分子進行了虛擬篩選及分子對接以尋找骨架和不同官能團的最佳組合。最終確定的兩種化合物對DDR1 表現出有效的抑制活性(化合物1 IC50 = 10.2 ± 1.2 nM,化合物2 IC50 = 10.6 ± 1.9 nM)。化合物2是迄今為止最具激酶選擇性的 DDR1 抑制劑之一。該方法為進一步基於骨架的藥物最佳化提供了寶貴的工具。
參考文獻
Tan, X.; Li, C.; Yang, R.; Zhao, S.; Li, F.; Li, X.; Chen, L.; Wan, X.; Liu, X.; Yang, T.; Tong, X.; Xu, T.; Cui, R.; Jiang, H.; Zhang, S.; Liu, H.; Zheng, M., Discovery of Pyrazolo[3,4-d]pyridazinone Derivatives as Selective DDR1 Inhibitors via Deep Learning Based Design, Synthesis, and Biological Evaluation. J Med Chem 2021.
中大唯信頭條號與中大唯信公眾號、唯信計算訂閱號均由中大唯信科技有限公司運營,歡迎關注轉發,未經授權禁止轉載