一項新的癌症研究報告說,DNA表現為結狀摺疊和DNA兩鏈之間的第三層“階梯”可能會推動癌症的發展,一種重要的調節酶可能與這些不尋常結構的形成有關。
來自美國西北大學醫學院和拉霍亞免疫學研究所(LJI)的科學家們發現,TET酶(一種對去除DNA甲基化標記至關重要的酶家族)的缺失與B細胞淋巴瘤有關。TET酶的活性降低在許多不同的癌症中很常見。瞭解TET功能喪失後癌症發展背後的機制可能為針對多種癌症的新藥物治療策略開啟大門。
這項研究最近發表在《自然-免疫學》雜誌上。
以前的研究表明,癌細胞的特定突變會導致血癌和實體癌患者的TET功能喪失,造成細胞通訊的延遲。過去的研究還發現了基因組的不穩定性,如癌細胞中DNA程式碼的雙鏈斷裂。
在此之前,這兩個危險的細胞特徵還沒有被聯絡起來。
DNA中出現奇怪的、不尋常的結構
西北大學範伯格醫學院細胞和發育生物學副教授Vipul Shukla與LJI癌症免疫治療中心的教授Anjana Rao和加州大學聖迭戈分校的研究生Daniela Samaniego-Castruita希望探索TET缺陷和基因組不穩定可能存在聯絡的一種潛在方式。
Shukla說:“TET功能的喪失發生在癌症中;基因組不穩定性發生在癌症中。基因組不穩定性也發生在TET缺陷的細胞中。我們發現的是,DNA二級結構調節的改變可能是這兩個事件如何相互關聯的原因。”
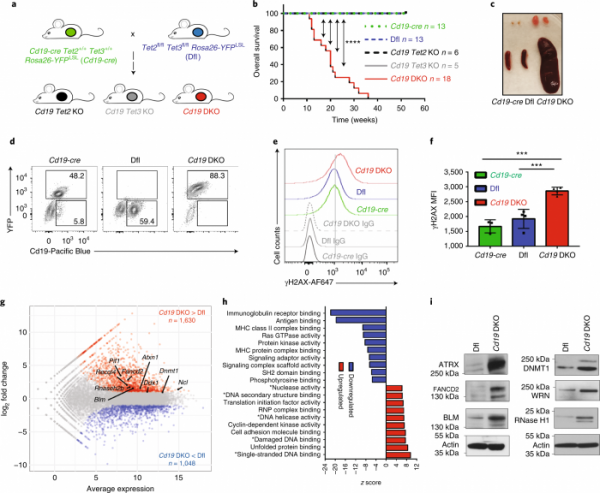
該科學家首先刪除了小鼠成熟B細胞中的兩種TET酶(TET2和TET3)。作為白細胞的一種型別,B細胞為免疫系統製造抗體以保護我們的身體免受感染。據Shukla說,刪除TET酶對B細胞的平衡有巨大影響,基因組不穩定開始出現。
Samaniego-Castruita說:“TET缺陷的小鼠患上了淋巴瘤,我們觀察到與基因組不穩定有關的標記增加,例如雙鏈斷裂。”
研究小組隨後透過進行基因組分析來尋找分子層面上發生的事情的線索,並發現如果沒有TET2和TET3,B細胞的DNA中開始出現被稱為G-四鏈體和R-環的不尋常結構。

通常情況下,DNA看起來像兩條平行的火車軌道。當蛋白質沿著軌道移動並“閱讀和交流程式碼”時,它們將軌道稍微拉開。但這兩種DNA結構似乎都使細胞難以讀取DNA程式碼。由RNA組成的R環作為DNA的“第三條鐵軌滑入”,而G-四鏈體則作為結點出現在外軌上,使原始鏈難以"解壓"。
根據Shukla的說法,這些結構使DNA位點非常脆弱和易斷。Shukla說:“它們在DNA中起著阻礙作用,如果它們不能正常解決,就會導致基因組的不穩定。這項研究啟迪我們,至少TET缺陷的細胞有更多的基因組不穩定性的原因之一可能是由於這些結構的積累。”
瞭解危險的基因組不穩定性和告訴TET突變是如何相互作用的,使該團隊在瞭解B細胞惡性腫瘤方面更近一步。
Shukla說,他想知道為什麼這些結構首先出現,因為這樣他的團隊就能更多地瞭解如何阻止它們的形成。他們研究了一種名為DNMT1的調節酶,該酶似乎隨著TET水平而改變。
在TET缺陷的B細胞中,幫助維持DNA甲基化的蛋白質DNMT1的水平更高。DNA甲基化是基因組中的一個重要調節標誌,通常由TET酶去除。
該小組想看看在TET缺陷的B細胞中刪除DNMT1蛋白是否能恢復G-四鏈體和R-環結構的平衡。
值得注意的是,刪除DNMT1與侵略性B細胞淋巴瘤的發展明顯延遲有關。正如人們所希望的那樣,它還與G-四鏈體和R-環的水平下降有關。
研究人員計劃進一步探索TET酶的影響,並相信調節G-四鏈體和R-環可能是TET酶控制基因組穩定性的許多方式之一。在未來,該論文的發現可以用來幫助不同型別的癌症患者。
Shukla的實驗室最終希望看到藥物如何能夠穩定異常結構,並作為一種有效的治療方法來治療許多癌症的惡性細胞。Shukla說有很多潛力,還有很多東西需要學習。
“這些結構就像黑匣子,”Shukla說。“因為通常當你想到DNA時,你會想到一個有四個字母的線性程式碼。但是這要求你不僅要考慮序列本身,還要考慮DNA除了雙螺旋之外還能摺疊成其他構象的方式。這項研究揭示了基因組生物學的一個新方面。”