本文轉自:上海國際乳腺癌論壇(SIBCS)公眾號,原文標題:病理完全緩解能否作為替代終點?
由於早期乳腺癌患者生存時間較長,等待隨機對照試驗的最終結果通常需要五年甚至十年。為了解決加快藥物審批的需求,使患者能夠更快、更有效、更經濟地獲得有效治療,美國食品藥品管理局(FDA)和歐洲藥品管理局(EMA)先後於2012年和2014年批准將術前新輔助治療後的病理完全緩解(pCR)作為隨機對照試驗長期臨床結局(無事件或無病生存和總生存)替代終點,用於新藥加速審批。
支援FDA和EMA決策的證據,主要來自FDA資助的12項隨機對照試驗患者個體資料薈萃分析(下圖所示的文獻)。該分析有力表明,病理完全緩解與患者水平無病生存和總生存顯著相關,但是試驗水平未能顯示出統計學顯著相關性。
一個好的替代終點必須被證實與真正終點有因果關係,並可預測治療對真正終點的整體影響。從臨床實踐而言,這意味著一個好的替代終點應該滿足與患者水平和試驗水平真正終點有意義相關性的條件。患者水平相關性強表明替代指標與真正終點可能存在因果關係,而試驗水平相關性強表明替代指標占據了真正終點的大部分治療效果。不過,終點之間的試驗水平相關性並不簡單地與患者水平相關性一致。
替代終點與幾類腫瘤患者個體水平和試驗水平生存結局的相關性具有統計學意義。例如HER2陽性早期乳腺癌的無病生存、早期結直腸癌的無病生存期、晚期結直腸癌的無進展生存。FDA對乳腺癌的薈萃分析試驗水平未能顯示病理完全緩解可作為替代終點,可能由於所分析的試驗數量有限,尤其考慮到各個試驗的治療效果差異幾乎都不大(即:分析納入12項試驗報告的病理完全緩解比值比、無病生存和總生存風險比幅度都不大)。
此外,替代分析的說服力可能受到採用風險比作為衡量治療對無病生存和總生存影響指標的影響。雖然風險比是乳腺癌術後輔助和術前新輔助試驗衡量治療效果的金標準,但是可能受到比例風險假設缺失的影響。為了解釋由於不成比例而導致的潛在說服力不足,替代分析應對許多試驗進行。
2014年,義大利學者對29項隨機對照試驗彙總資料進行的薈萃分析(下圖所示的文獻)也未能在試驗水平證實病理完全緩解作為無病生存和總生存替代終點具有統計學意義。不過,該分析也有若干侷限性,其中最重要的是尚未根據疾病生物學特徵評估結果潛在的異質性。FDA發起的分析和義大利學者的分析共有的另一個重要侷限性是,這些分析僅納入檢驗化療的隨機對照試驗,而且大多數為舊方案,僅兩項抗HER2靶向治療試驗除外。
2020年,FDA關於採用病理完全緩解作為終點以支援加速批准的指導意見強調了影響既往分析結果的全部侷限性,並認識到進一步分析克服這些侷限性的重要價值。2021年,聖加侖國際乳腺癌共識會議也討論了病理完全緩解替代價值的爭議,其中僅40%的專家組成員支援將其作為定義早期乳腺癌術後輔助或術前新輔助全身治療方案標準的合適終點。
由於現在已有越來越多的試驗結果可供分析,故有必要對檢驗早期乳腺癌術前新輔助治療的全部隨機對照試驗進行薈萃分析,從試驗水平重新評定病理完全緩解作為患者長期結局替代終點的有效性。
2021年12月21日,全球四大醫學期刊之一、英國醫學會《英國醫學雜誌》(BMJ)正刊線上發表歐洲癌症研究院、義大利米蘭大學、米蘭比可卡大學、佈雷西亞大學、瑞士南方腫瘤研究所、美國哈佛大學醫學院、哈佛大學陳曾熙公共衛生學院、波士頓前沿科學技術研究基金會的研究報告,對檢驗早期乳腺癌術前新輔助治療的全部隨機對照試驗進行了薈萃分析,從試驗水平重新評定了病理完全緩解作為患者無病生存和總生存替代終點的有效性。(下圖所示的文獻)
該系統回顧和薈萃分析對美國國家醫學圖書館文獻資料庫、荷蘭醫學文摘資料庫、愛思唯爾文獻資料庫截至2020年12月1日收錄的早期乳腺癌術前新輔助化療±其他治療(包括抗HER2藥物、靶向治療、抗血管藥物、雙膦酸鹽、免疫檢查點抑制劑)隨機對照試驗進行檢索,分析替代終點病理完全緩解與無病生存和總生存的試驗水平相關性。對經過對數轉換的治療效果估算值(無病生存和總生存的風險比、病理完全緩解的相對風險)進行加權迴歸分析,並採用決定係數R2對相關性進行量化。
該研究次要目標為探索預設亞組分析結果的異質性,根據實驗組治療型別、病理完全緩解型別(乳房+淋巴結、僅乳房)以及病灶生物學特徵(HER2陽性或三陰性乳腺癌)對試驗進行分層。該研究還評估了替代臨界值,即自信地預測對無病生存或總生存風險比的非零效應所必需的病理完全緩解相對風險最小值。
結果,54項隨機對照試驗共計3萬2611例患者被納入分析。
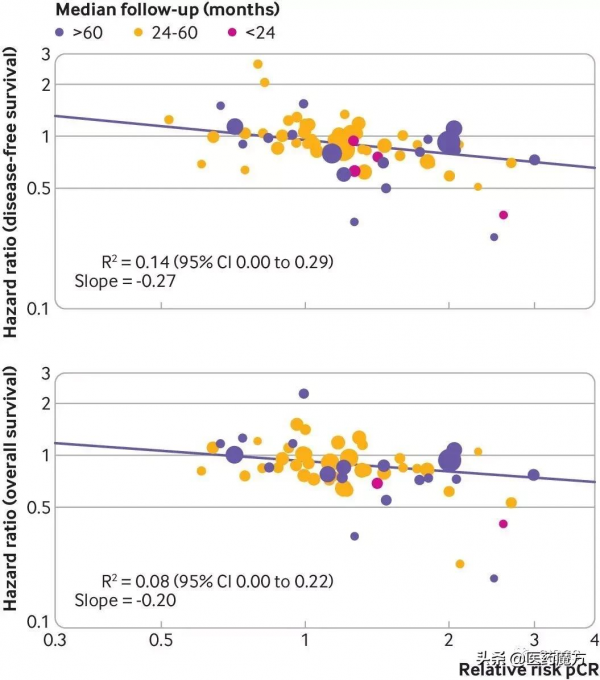
病理完全緩解相對風險對數值與無病生存和總生存風險比對數值相關性較弱(R2=0.14和0.08,95%置信區間:0.00~0.29和0.00~0.22)。
被評估的全部亞組都發現類似結果,無論病理完全緩解型別、實驗組治療型別、病灶生物學特徵如何。
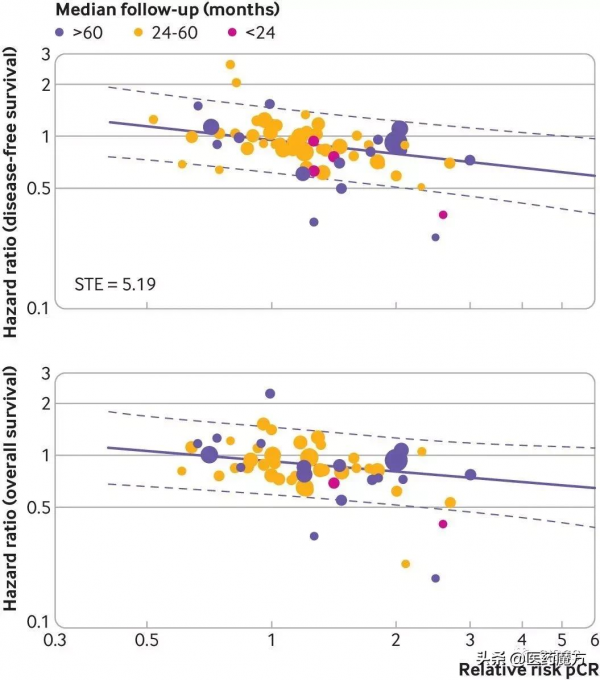
病理完全緩解替代無病生存的臨界值為5.19,但是無法替代總生存。
三項敏感性分析(剔除入組患者<200例的小樣本試驗、剔除中位隨訪時間<24個月的試驗、用治療組之間的病理完全緩解率絕對差代替病理完全緩解相對風險)證實與上述結果一致。
因此,該研究結果表明,病理完全緩解在試驗水平無法替代無病生存和總生存,病理完全緩解不應作為早期乳腺癌術前新輔助試驗監管的主要終點。
參考文獻
BMJ. 2021 Dec 21; 375: e066381.