隨著免疫治療的快速發展,免疫聯合靶向治療已成為轉移性腎細胞癌的主要一線治療方案之一。IMmotion151研究中期分析顯示,阿替利珠單抗+貝伐珠單抗對比舒尼替尼可明顯改善患者無進展生存期(PFS),達到主要研究終點。近日,該研究公佈最終總生存(OS)結果及生物標誌物探索性分析結果。
背景
IMmotion151研究是一項多中心、開放標籤III期臨床研究,旨在評估阿替利珠單抗+貝伐珠單抗對比舒尼替尼用於初治轉移性腎癌的療效和安全性。中期分析顯示,與舒尼替尼相比,阿替利珠單抗+貝伐珠單抗可顯著延長PFS,且具有較好的安全性,但OS無顯著差異。
方法
該研究納入21個國家152個醫療中心接受治療患者,入組患者以透明細胞或肉瘤樣組織學為特徵,具可測量病灶,足夠的體能狀態,血液學和器官功能合適,有足夠腫瘤組織可進行PD-L1表達分析。患者每3周接受阿替利珠單抗(1200mg,IV)+貝伐珠單抗(15mg/kg,IV)或接受每日口服舒尼替尼(50mg)(連續4周,停藥2周)。共同主要終點為PD-L1陽性患者PFS和ITT人群的OS。探索性分析包括PD-L1陽性人群OS、轉錄組學相關性和安全性。
透過RNA測序將接受治療患者的腫瘤組織(n = 823)進行了分類並進行了OS探索性分析。1組為抗血管生成/基質;2組為抗血管生成相關;3組為補體/氧化;4組為T效應子/增殖相關;5組為增殖相關;6組為基質/增殖相關;7組為snoRNA。
主要結果
IMmotion151最終分析評估了915例轉移性腎細胞癌患者,替利珠單抗+貝伐珠單抗和舒尼替尼組的中位年齡分別為62歲和60歲。總人群中,669例(73.1%)患者為男性,246例(26.9%)患者為女性。2020年2月14日資料截止時,中位隨訪時間為40個月,接受阿替利珠單抗、貝伐珠單抗、舒尼替尼的中位治療持續時間分別為12.7個月、11.8個月和9.2個月。
OS最終分析
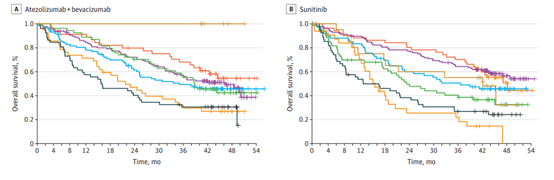
OS事件發生率55%(504/915),阿替利珠單抗+貝伐珠單抗和舒尼替尼組的中位OS分別為36.1個月和35.3個月(HR=0.91),PD-L1陽性人群中,兩治療組的中位OS分別為38.7個月和31.6個月(HR=0.85)(圖1)。
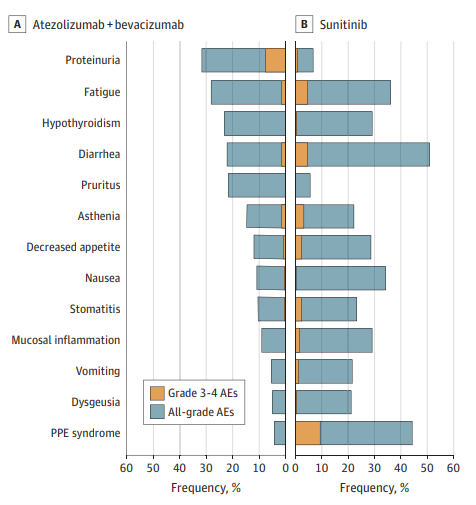
聯合組3~4級治療相關不良事件發生率分別為46%,3~4級治療相關不良事件為蛋白尿 (8%)(圖2)。
生物標誌物分析
既往轉錄組分析確定了以不同基因表達譜為特徵的7個分子亞組,本研究報告了各分子亞組與PFS的相關性。與PFS結果類似,兩治療組中,1組和2組的OS更長;相反,5組、6組的OS更短(圖3)。
舒尼替尼組2組和聯合組的4組、5組、7組的OS得到改善(圖 4)。
結論
與舒尼替尼相比,阿替利珠單抗+貝伐珠單抗並未明顯改善初治轉移性腎細胞患者的OS。但生物標誌物分析為接受不同治療患者帶來更多生存獲益提供了新視角/新思路。併為抗血管生成藥物、免疫檢查抑制劑及聯合療法的開發提供了新方向。
參考文獻:
Robert J. Motzer, Thomas Powles et al.Final Overall Survival and Molecular Analysis in IMmotion151, a Phase 3 Trial Comparing Atezolizumab Plus Bevacizumab vs Sunitinib in Patients With Previously Untreated Metastatic Renal Cell Carcinoma.JAMA Oncol. doi:10.1001/jamaoncol.2021.5981 Published online December 23, 2021