視覺化生命分子動力學
理解複雜和/或快速的細胞動力學是探索生物過程的重要一步。因此,當今的生命科學研究越來越關注實時動態過程,如細胞遷移,細胞、器官或整個動物的形態變化以及活體標本的實時生理(例如細胞內離子組分的變化)事件。解決這些挑戰性需求的一種方式是採用被統稱為活細胞成像的光學方法。活細胞成像可研究活細胞的動態過程,而非提供細胞當前狀態的“快照”——它把快照變成了電影。活細胞成像可提供單個細胞、細胞網路(原位)甚至整個生物體(體內)中動態事件的空間和時間資訊。這些特點讓活細胞成像成為解決細胞生物學、癌症研究、發育生物學和神經科學問題的必要技術。
近年來,電子學、光學和分子生物學都取得了重大進步,科學家們可以很容易地進行活細胞成像。
用於活細胞成像的方法
顯微技術在活細胞成像方面的應用也非常廣泛。通常,使用複合顯微鏡和對比方法(例如相差和微分干涉相差(DIC))隨著時間觀察細胞的生長,細胞聚集或細胞運動。此外,通常使用立體顯微鏡或宏觀鏡進行較大樣本(例如斑馬魚胚胎髮育)的延時成像。在過去數十年中,先進熒光技術變得越來越重要。隨著共聚焦顯微鏡應用的迅速增加,生物研究的視角已由平面轉向三維。以下是一些常用技術的簡要概述。
離子成像——觀察離子濃度的變化
一種常用的方法是使用熒光染料或特別設計的蛋白質來改變其在鈣結合時的發射行為的離子成像(鈣、氯、鎂)。這使得研究人員可以觀察到細胞離子濃度的動態變化。由於細胞胞質溶膠中的離子組成決定了細胞的很多重要功能,如神經元的興奮性、基因轉錄和細胞運動(僅舉幾例),細胞內離子在空間和時間上的調節是生物學研究的主要興趣。此外,使用特殊的熒光染料可以對細胞內的pH值或電壓進行成像。一種用來對離子水平、pH值或電壓變化進行成像的特殊技術是比率成像法。這些方法能夠精確確定細胞內鈣濃度等資訊,而非像非比率方法那樣監測相對變化。
FRET – 量化蛋白質-蛋白質相互作用
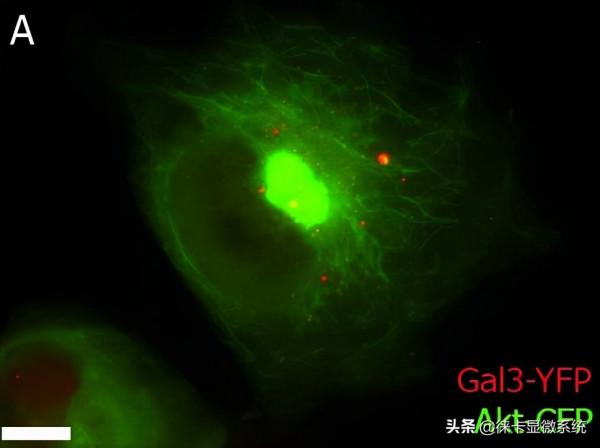
要檢測動態蛋白質相互作用,可以在活細胞實驗中對FRET(熒光共振能量轉移)和BRET(生物發光共振能量轉移)事件進行成像。FRET是量化分子動力學的有利工具,如蛋白質-蛋白質相互作用、蛋白質-DNA相互作用和蛋白質構象變化等。FRET成像通常使用GFP(綠色熒光蛋白)的衍生物,尤其是CFP和YFP(分別為青色和黃色熒光蛋白),它們各自使用分子生物學方法連線到感興趣的目的蛋白質上。然後用熒光激發CFP分子。一旦目的蛋白質在空間上接近(<20 nm),CFP將作為供體並以光的形式發射能量轉移給作為受體的YFP。研究人員將觀察到從CFP發出的藍色熒光轉變為從YFP發出的黃色熒光。使用BRET時,供體是生物發光分子(例如熒光素酶衍生物),與FRET一樣,GFP衍生物作為受體。
圖1:擬南芥的共聚焦活細胞影象;內質網:GFP標記為綠色,自發熒光葉綠體為紅色,透射光為藍色。基於這樣的影象,可以完成FRET或FRAP等分析。
FRAP–監測蛋白質和囊泡轉運
光漂白後熒光恢復(FRAP)是一種常用的監測蛋白質或囊泡轉運的方法。熒光蛋白(通常是GFP)附著在目的蛋白質上(即要監測此蛋白質的運動)。通常情況下,整個細胞最初發出熒光,因為整個細胞中可能含有豐富的蛋白質。然後細胞的某個區域,通常是神經元細胞中的細胞突起,如軸突或樹突,暴露在高強度的光下(通常是鐳射),該特定區域的熒光被破壞(漂白)。隨著目的蛋白質的移動,來自細胞其他區域的蛋白質會以一定的速度重新侵入漂白區域,然後漂白區域的熒光恢復。這能讓研究人員深入瞭解胞內運輸動力學。
TIRF–觀察靠近細胞膜的生物程序
TIRF(全內反射)顯微鏡是一種特殊技術,用於觀察位於或靠近細胞質膜的事件。TIRF顯微鏡使用僅穿透細胞60-250 nm的瞬逝場進行熒光染料激發,可提供出色的z解析度,從而能對質膜中或附近發生的事件進行成像(例如分子運輸至質膜),而不會被細胞內分子發出的熒光所掩蓋。
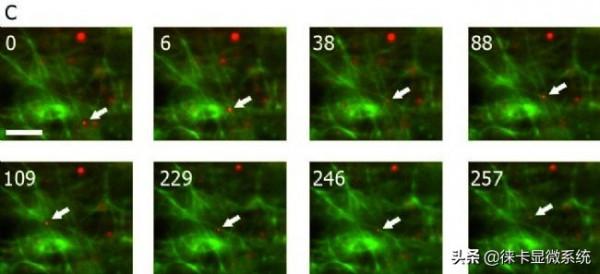
TIRF影象:靠近膜的Galectin-3(半乳糖凝集素3)囊泡沿肌動蛋白絲的運輸。
圖2A:落射熒光概覽影象,
圖2B:TIRF概覽影象,框選部分如C所示,
圖2C:TIRF截面的時間序列;時間以秒為單位。靠近膜(箭頭)的Galectin-3囊泡(用YFP標記)首先沿著肌動蛋白絲(從底部向上)運輸,轉移到另一條肌動蛋白絲(88秒),向左移動(109秒),再向右運輸,再次轉換肌動蛋白絲,然後向上運輸(246秒)。
YFP:紅色;CFP:綠色;概覽影象的標尺:20 µm;截面:6 µm;TIRF穿透深度:110 nm。由德國馬爾堡大學的Ralf Jacob提供
光活化——監測基因表達和蛋白質轉運
最近開發的一種被稱為光活化的方法能夠選擇性地標記細胞或整個生物體內的特定區域或感興趣區域。進行光活化時,使用專門設計的染料或熒光蛋白,如光活化綠色熒光蛋白(paGFP)或Kaede。這些熒光團在正常狀態下不發熒光。但在用特定波長的光照射後,它們可以像傳統熒光團一樣被啟用,發出熒光。在很多情況下,將這些蛋白質與某些目的蛋白質進行基因融合,可以監測其表達或轉運。然後可以應用FRAP或粒子跟蹤等方法來進一步研究目的蛋白質。
MPE–深入研究程序
在細胞培養實驗中,現代生物學研究需要真正的體內研究來補充“類似體內”研究。但很難研究像老鼠這樣的生物體內發生的過程。多光子激發(MPE)顯微鏡能夠更深入地穿透組織,因為與用於單光子激發的短波長光相比,近紅外激發光具有更長的波長,散射更少。MPE技術的非線性特性將光漂白和光毒性限制在焦點區域。這對長期研究非常有益,因為熒光蛋白和生物體都受到這些問題的困擾。據報告,使用合適的標本和顯微鏡設定,成像深度可以深入組織中數毫米。激發的精確定位使其也適用於光子操縱。該方法在神經生物學中得到了廣泛的應用。
STED——奈米級的細胞動力學研究
受激發射損耗(STED)顯微鏡使科學家能夠研究超出光學解析度極限的結構。該技術利用熒光染料的特性,受激發射,以消除可檢測的訊號。目前已成功成像50-70 nm的細胞內結構。提高解析度對於研究小的細胞內結構非常重要。尤其是對於想研究共定位事件的人來說,提高解析度可以產生更真實的結果。與其他超解析度技術相比,STED的隨機獨立效能夠實現極為快速的成像。已實現影片速率STED採集,可以實時研究細胞動力學。
圖3:使用snap-tag技術的STED活細胞成像:Vero細胞,結構:EB3,瞬時轉染;標籤:Oregon Green 488。
FLIM–活細胞的空間測量
熒光壽命成像的優點是資料不依賴於訊號強度。因此不受光漂白和濃度變化等常見偽影的影響。使用時間相關的單光子計數,透過單分子檢測資料重建FLIM影象。可以記錄和分析亞納秒熒光壽命的最小變化。該方法可用於研究導致熒光壽命改變的任何型別的細胞外和細胞內環境改變。基於FLIM的FRET分析對發射強度不敏感,從而提高了定量資料的精度。
CARS和SRS – 使用振動對比的無標記方法
幾乎所有的活細胞熒光成像方法都基於熒光蛋白的基因表達。這涉及到大量的技術工作和高昂的費用。此外,外部基因的表達可能會改變微環境,從而導致資料與實際生理學情況的差異。相干反斯托克斯拉曼散射(CARS)顯微鏡和受激拉曼散射(SRS)顯微鏡是不依賴於熒光染料的非線性共聚焦方法。這些無標記方法可對樣品中特定化學鍵的振動狀態進行成像。生物體中特定化學鍵的積累,例如軸突周圍髓鞘中的脂質,可以在無需染色的情況下以高解析度和出色的信噪比質量進行成像。
未來屬於定量分析
生物學研究已經脫離了描述性研究的時代,進入了定量分析的時代。新的活細胞成像技術在空間和時間上都朝著解析度更高的方向發展。目前的技術發展主要是在奈米範圍內對單個分子和短至幾皮秒的分子反應進行定量研究。