原創 未晞 米內網
精彩內容
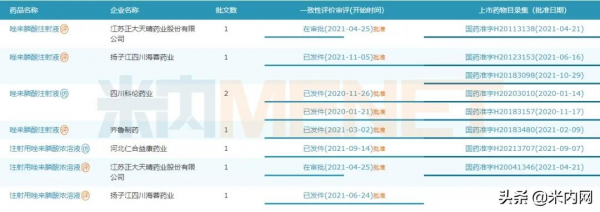
2022年1月5日,NMPA釋出最新藥品獲批資訊,石藥集團恩必普藥業的唑來膦酸注射液3類仿製上市申請獲批,成為該產品的國產第六家企業。此外,石藥集團中諾藥業(石家莊)的鹽酸米託蒽醌脂質體注射液2.2類新藥上市申請在近期進入了行政審批,即將迎來喜訊。
圖1:石藥最新獲批產品情況
來源:NMPA官網
圖2:唑來膦酸的銷售情況(單位:萬元)
來源:米內網中國公立醫療機構終端競爭格局
唑來膦酸可用於治療惡性腫瘤引起的高鈣血癥,以及聯合標準抗腫瘤藥物用於治療實體腫瘤骨轉移患者和多發性骨髓瘤患者的骨骼損害。米內網資料顯示,2018年在中國城市公立醫院、縣級公立醫院、城市社群中心及鄉鎮衛生院(簡稱中國公立醫療機構)終端,唑來膦酸的銷售額已超過20億元,2021年在治療骨骼疾病的藥物品種TOP20中排在首位,目前市場上的主要劑型為注射劑。
圖3:唑來膦酸早前過評企業情況
來源:米內網一致性評價資料庫
唑來膦酸注射液早前已有5家企業獲得批文,其中揚子江、科倫、齊魯、正大天晴已過評,作為國內龍頭梯隊的石藥也拿下了這個大品種。此外,注射用唑來膦酸濃溶液也有3家企業過評,若該品種成為第七批國採的目標,石藥有望參與市場爭奪。
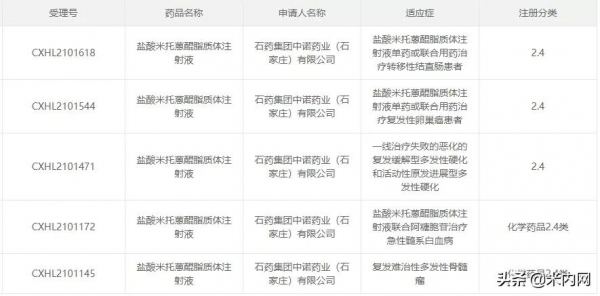
目前國內市場已上市的脂質體制劑包括了鹽酸多柔比星脂質體注射液、注射用兩性黴素B脂質體以及注射用紫杉醇脂質體,石藥集團的鹽酸多柔比星脂質體注射液2020年在中國公立醫療機構終端及中國城市實體藥店終端合計銷售已超過25億元,已成為是國內最暢銷的脂質體制劑。同時,石藥近年來在脂質體研發領域不斷深耕,公司在2020年8月首家申報鹽酸米託蒽醌脂質體注射液2.2類新藥上市,用於既往至少經過一線標準治療的復發或難治的外周T細胞淋巴瘤患者,若該新藥順利獲批,有望成為石藥旗下第二個重磅脂質體產品,也將成為國內第四個脂質體產品。
圖4:鹽酸米託蒽醌脂質體注射液已獲批臨床的新適應症
來源:CDE官網
石藥集團對鹽酸米託蒽醌脂質體注射液寄予了很高的期望,目前已有5個新適應症獲批臨床。該新藥用於急性髓系白血病的Ib/II期臨床正在進行中,而復發/難治多發性骨髓瘤的I期臨床也正在進行中。可以預見,該產品入市後隨著新適應症陸續獲批,未來的市場空間將是巨大的。
來源:NMPA官網、CDE官網、米內網資料庫
審評資料統計截至1月6日,如有錯漏,敬請指正。