前言:新輔助化療的病理完全緩解(pCR)定義為乳腺和腋窩無殘留侵襲性疾病,與改善長期生存結果密切相關。CTNeoBC薈萃研究證實,新輔助治療後達pCR的患者改善了無事件生存期(EFS)和總生存期(OS),在高增殖腫瘤患者中具有最大的預後價值。因此,2012年1月4日,美國食品和藥物管理局(FDA)和歐洲藥品管理局(EMA)釋出了初步指南,將pCR作為加速批准乳腺癌新輔助化療新藥的監管終點。
20世紀70年代後期,新輔助化療誕生,用於區域性晚期不能手術的乳腺癌患者的治療。與輔助治療相比,術前新輔助治療可以縮小腫瘤體積並降低患者腫瘤分期,從而允許患者進行更多的乳房和腋窩手術,這也為患者的治療提供了重要的預後資訊。殘留癌症負荷(RCB)評分於2007年首次提出,旨在透過提供一套標準方法來評估和量化新輔助化療後乳腺和腋下淋巴結殘留疾病的程度,從而解決這些缺陷產生一個連續的分數。但RCB的預後價值尚未在大型研究中被證實,且各分子亞型中RCB的預後價值是否存在差異也有待證實。日前, Lancet Oncol發表了一項5161名患者的資料分析,證實了新輔助化療RCB評分可預測所有亞型患者的長期預後。
既往研究已經驗證了新輔助化療後殘留癌症負荷(RCB)的預後相關性。此次彙總分析使用了幾個獨立佇列的患者資料結果,來評估RCB與乳腺癌不同亞型長期預後的關係,以分析其在廣泛的實踐環境中的普遍性。
在這項彙總分析中,透過與現場調查人員的溝通,確定了歐洲和美國12個研究所和相關臨床試驗(4項隨機對照試驗、8項佇列研究),其中包括1994年9月12日至2019年2月11日接受新輔助化療的5161名患者的資料。2019年11月,我們從接受新輔助化療和手術治療的原發性Ⅰ~ Ⅲ期乳腺癌患者(18歲)中獲得了參與者的RCB結果、臨床和病理分期、腫瘤亞型和分級、治療和隨訪資料。研究者使用混合效應Cox模型,結合隨機RCB和佇列效應,評估了連續RCB評分與主要研究結局(無事件生存率)之間的相關性,以解釋研究之間的異質性,並分層以解釋激素受體狀態和HER2狀態定義的不同癌症亞型的基線風險差異。
在多變數分析中,結合隨機RCB和佇列效應以及年齡和治療前臨床T分類、淋巴結狀態和腫瘤分級的調整,進一步評估每個乳腺癌亞型之間的相關性。Kaplan-Meier對每個亞型中每個RCB類別的3年、5年和10年無事件生存(EFS)率進行了估計。
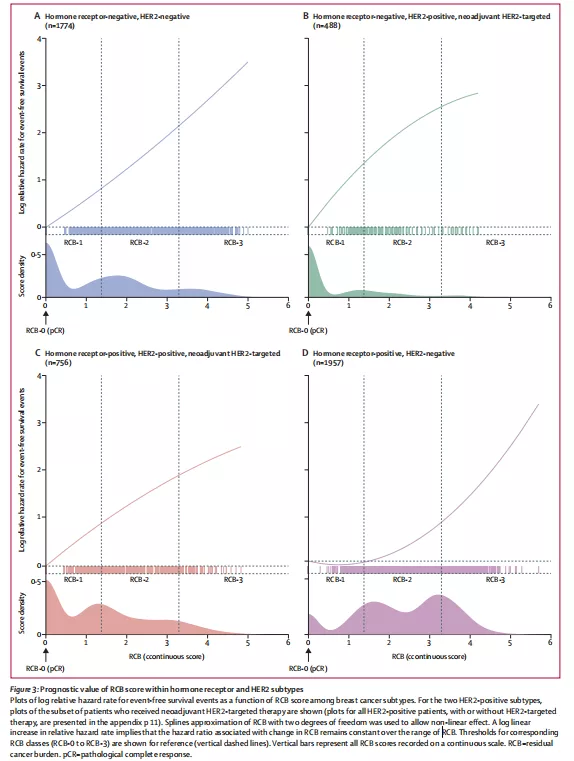
患者的中位年齡為49歲(IQR:20~80)。隨訪中出現1164例EFS(中位隨訪56個月[IQR:0~186])。RCB評分對每個乳腺癌亞型都有預後意義,在總體人群中,單變數分析顯示,RCB評分的增加與較差的EFS和遠期無復發生存(DRFS)顯著相關,EFS率和DRFS率的相對危險度隨RCB評分的增加而增大,與總人群呈近線性關係(圖2A、2B)。在每個參與佇列中都觀察到RCB評分與EFS和DRFS類似的關聯。
RCB每增加一個單位,相關的單變數復發/死亡危險比(HR)均有增加:HR+/HER2-患者增加1.55倍(95% CI:1.41~1.71);HR-/HER2+患者增加2.16倍(95% CI:1.79~2.61)(無論有無HER2靶向治療;所有亞型P<0.0001)。
在根據年齡、分級、T分期和基線淋巴結狀態調整後的多變數模型中,RCB評分仍然是EFS的預後評價指標:調整後患者復發/死亡風險仍然顯著較高。HR+/HER2-患者的風險比:1.52(95% CI:1.36~1.69);HR-/HER2+患者的風險比:2.09(95% CI:1.73~2.53)(所有亞型P<0.0001)。
研究結果表明,RCB評分及其分類是各種乳腺癌亞型的獨立預後因素,並可推廣到多種臨床實踐環境。儘管不同患者在激素受體亞型定義和治療上的差異可能會影響預後表現,但我們觀察到的RCB與患者殘癌風險之間的關聯表明,對RCB的前瞻性評估可以被認為是新輔助治療後標準病理報告的一部分。
參考文獻:
Yau, C., Osdoit, M., van der Noordaa, M., Shad, S., Wei, J., de Croze, D., Hamy, A. S., Laé, M., Reyal, F., Sonke, G. S., Steenbruggen, T. G., van Seijen, M., Wesseling, J., Martín, M., Del Monte-Millán, M., López-Tarruella, S., I-SPY 2 Trial Consortium, Boughey, J. C., Goetz, M. P., Hoskin, T., … Symmans, W. F. (2022). Residual cancer burden after neoadjuvant chemotherapy and long-term survival outcomes in breast cancer: a multicentre pooled analysis of 5161 patients. The Lancet. Oncology, 23(1), 149–160. https://doi.org/10.1016/S1470-2045(21)00589-1