1月4日,Nature雜誌對2021年美國FDA批准的新藥做了盤點,並對銷售額做了預測。此外還對2022年將獲批新藥做了統計。
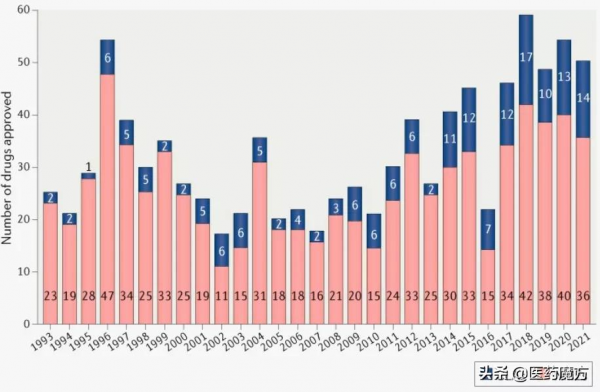
儘管COVID-19的影響持續存在,但FDA去年的批准數量與近些年的趨勢一致。FDA藥物評價與研究中心 (CDER) 在2021年批准了50款新型療法,低於2020年的53款。近5年CDER平均每年批准51款新藥。十年前,則為每年24款。
1993年以來FDA批准的新藥數量
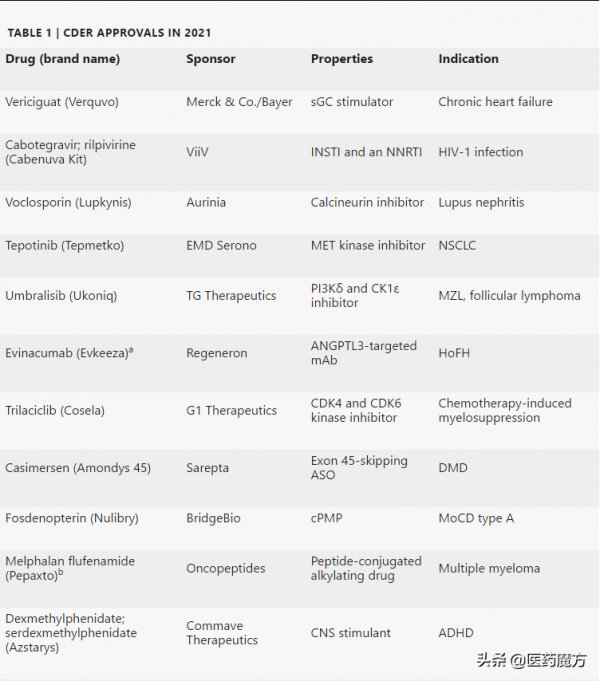
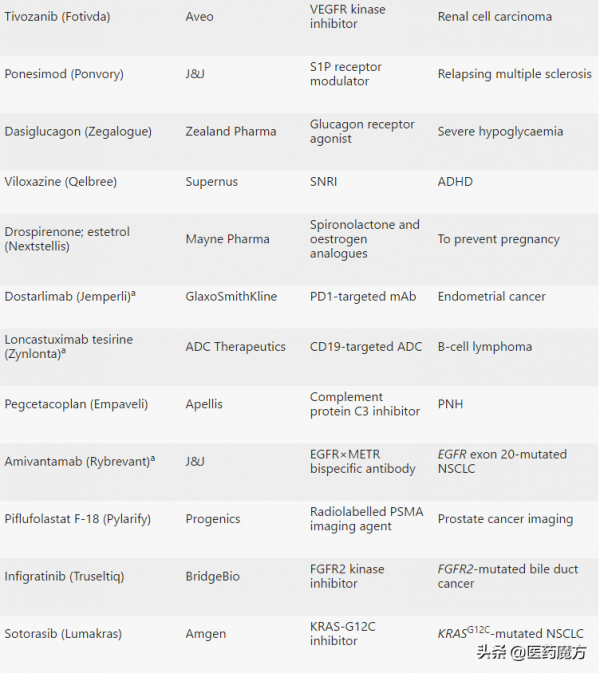
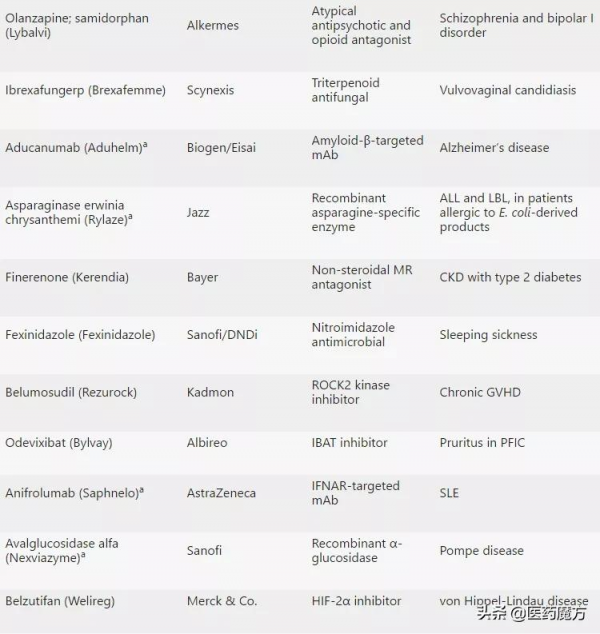
2021年CDER共批准了50款新藥,包括首款治療癌症的KRAS抑制劑和首款治療阿爾茨海默病的抗澱粉樣蛋白抗體。
2021年CDER批准的50款新藥
注:a:生物製品;b:撤市;
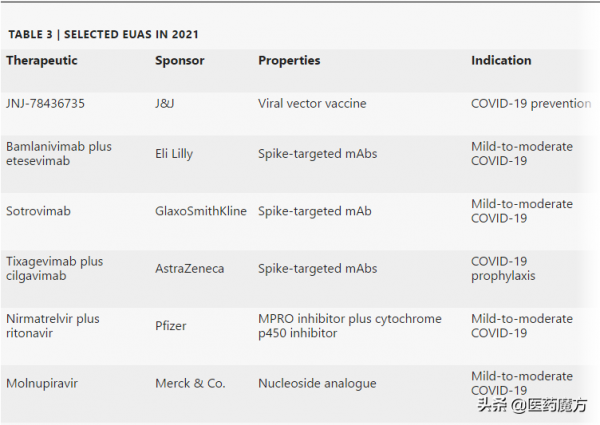
FDA生物製品評估和研究中心 (CBER) 還批准了具有里程碑意義的mRNA疫苗和CAR-T細胞產品,並授予治療COVID-19的抗體和快速開發的口服抗病毒藥物緊急使用授權 (EUA) 。不過,CBER批准和EUA未被包括在年度新藥計數中。
2021年CBER批准的細胞療法和疫苗
2021年FDA授予EUA的產品
2021年,抗癌藥批准仍占主導地位,佔獲批新藥數量的30%(15),抗癌藥獲批的5年平均佔比為28%。神經科藥物獲得了第二多的批准,連續第三年有5個(10%)新藥獲批。傳染病和心血管疾病新藥並列第三,各有 4 (8%) 項批准。
CDER批准新藥所在領域
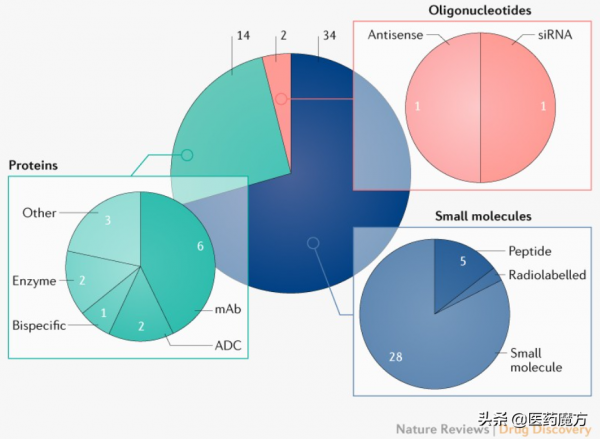
2021年CDER批准的新藥中,包含第100個抗體、兩款抗體-藥物偶聯物(ADC)、一款雙特異性抗體、一款限制性肽(constrained peptide)和兩款寡核苷酸藥物。
CDER按藥物型別的批准(“小分子”包括所有長達40個氨基酸的肽)
根據科睿唯安資料庫,分析師預計CDER批准的新藥中,僅有8款有潛力成為重磅炸彈。2027年,渤健(Biogen) 的aducanumab是其中唯一一個預計將突破20億美元大關的藥物,鑑於這款有爭議的阿爾茨海默病藥物面臨的不利因素,這也是一個投機性賭注。
2021獲批重磅炸彈2027年平均銷售預測
注:a:2027年平均銷售預測;b:2021年銷售預測。c:2025年銷售預測。
疫苗的勝利
CBER批准的疫苗是2021年“批准展”的明星。尤其是輝瑞/BioNTech的mRNA疫苗tozinameran (Comirnaty) ,開創了新的先例。
BioNTech於2020年1月開始研發這款COVID-19 mRNA疫苗,並於3月與輝瑞達成合作。II/III期試驗於7月進行,12月便提供了EUA的安全性和有效性資料。在該計劃啟動僅1.5年後,於2021年8月獲得FDA完全批准。一般而言,疫苗發現和開發的平均時間為10.7年。
Tozinameran也打破了商業記錄。分析師預測,其2021年銷售額將超過350億美元,排名第二的將是艾伯維 (AbbVie)上市19年的TNF阻斷劑阿達木單抗 (adalimumab) ,將超過210億美元。此前上市最好的藥物是吉利德的ledipasvir/sofosbuvir抗病毒組合,該組合上市的第一年就在丙肝市場賺了100多億美元。
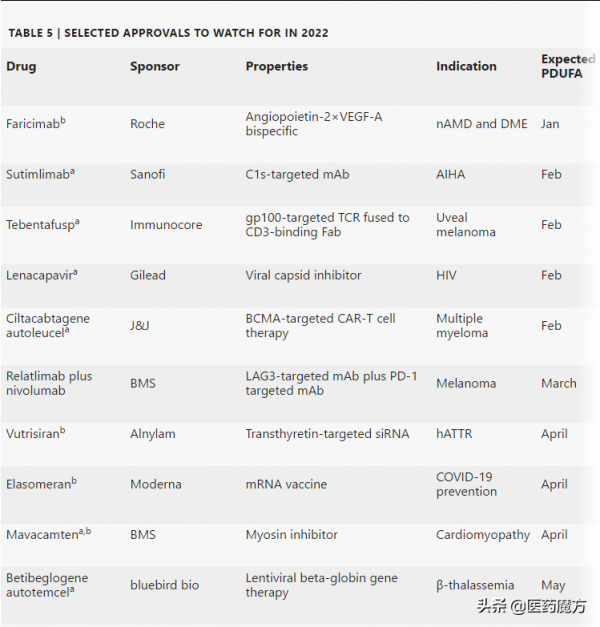
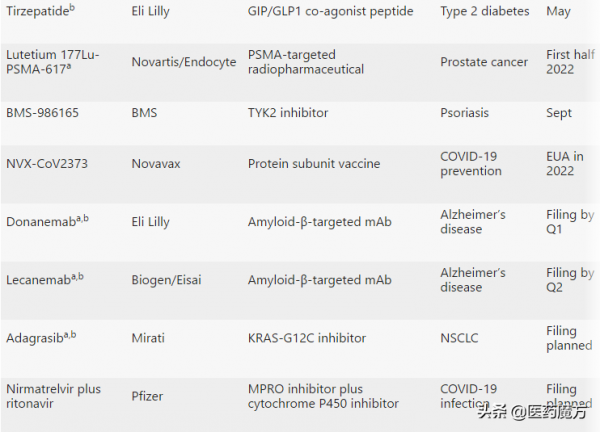
Moderna的elasomeran(Spikevax)在速度和盈利能力上都緊隨其後。Spikevax同樣於2020年12月獲得EUA。預計將於2022年4月獲得FDA的完全批准。分析師預測,2021年elasomeran銷售額將超過170億美元。其他有望在2022年獲FDA批准的新藥見下表:
2022年有望獲FDA批准新藥
注:a:突破性療法認定;b:根據Cortellis資料庫預測,到2027年將達到驚人銷售額
輝瑞的Prevnar 20是一款針對肺炎鏈球菌血清型的20價結合疫苗,預計到2027年銷售額將達到44億美元。Prevnar 20是Prevnar 13的下一代,Prevnar 13在tozinameran上市之前是全球最暢銷的疫苗。
分析師還預測默沙東新獲批的15價肺炎鏈球菌疫苗Vaxneuvance將會成為重磅炸彈。
癌症治療新突破
安進公司KRAS-G12C抑制劑sotorasib的獲批對癌症界來說是一個里程碑。
儘管sotorasib的療效在KRAS-G12C突變NSCLC患者中得到認可,但還沒有滿足期望。Amgen正在評估sotorasib與其他藥物聯合治療各種癌症的療效。分析師預測,2027年該產品銷售額將達到16億美元。
其他靶向KRAS療法正在研究中。Mirati預計其KRAS-G12C抑制劑adagasib將於2022年獲得批准。
FDA批准了默沙東first-in-class缺氧誘導因子-2α (HIF-2α)抑制劑,用於治療與VHL相關腫瘤,VHL是一種與血管浸潤性腫瘤相關的遺傳性疾病。對 VHL疾病生物學的數十年研究表明,HIF-2α是氧感應的關鍵驅動因素——為新型抗血管生成藥物鋪平了道路,Dana-Farber癌症研究所的William Kaelin等人因此而獲得了諾貝爾獎。
BMS的idecabtagene viceucel獲批用於多發性骨髓瘤,腫瘤醫師因此而獲得了首款靶向BCMA的CAR-T細胞療法。FDA批准的其他5款CAR-T細胞療法均靶向CD19。BCMA在B細胞表面表達,已成為抗體、雙特異性藥物、ADC和細胞療法的試驗場。
強生靶向BCMA的CAR-T療法ciltacabtagene autoleucel正在接受FDA審查。
葛蘭素史克PD1單抗dostarlimabshi FDA批准的第100個抗體藥物。35年前,FDA於1986年批准了首款抗體。如今,FDA每年批准大約10款基於抗體的產品。
Dostarlimab是FDA批准的第7款PD1/ PDL1單抗,儘管分析師預測默沙東的帕博利珠單抗到2027年的銷售額將超過300億美元,但他們預計dostarlimumab到2025年的銷售額僅為2.7億美元。
另外4款PD1/PDL1抗體有望在2022年獲FDA批准。FDA的Julia Beaver和Richard Pazdur最近寫道,檢查點抑制劑已經成為藥物開發的蠻荒之地,其標誌是“商業贊助商、臨床試驗和重複開發計劃的蜂擁而來”。他們敦促藥物開發人員更好地合作。
BMS提交了首個針對LAG 3的檢查點抑制劑relatlimab的BLA申請,FDA將於2022年做出審批決定。
2021年,FDA批准了兩款ADC。ADC Therapeutics的loncastuximab tesirine是一款靶向CD19的ADC,用於治療B細胞淋巴瘤。Seagen/Genmab的tisotumab vedotin是一款靶向組織因子的宮頸癌ADC。FDA目前批准ADC 的數量達到了11個,在過去3年批准了其中的7個。阿斯利康於2019年獲得FDA 批准的靶向HER2的ADC trastuzumab deruxtecan(DS-8201)的臨床資料表明,與抗體和之前批准的ADC相比,新型ADC具有更好的療效。
強生獲批新藥amivantamab是一款靶向EGFR和MET的雙特異性抗體,用於 EGFR exon 20突變的NSCLC,這一型別癌症對小分子EGFR抑制劑具有耐藥性。Amivantamab是第3款上市的雙抗,雙抗目前佔臨床階段抗體管線的近20%。
FDA還批准了武田的小分子激酶抑制劑mobocertinib,被設計能夠選擇性靶向exon 20突變的EGFR。
阿爾茨海默病新藥引起的爭議
FDA批准Biogen和衛材的靶向β-澱粉樣蛋白抗體aducanumab是今年最具爭議的審批決定。
2021年6月7日美國FDA不顧專家委員會的反對意見,基於臨床替代終點(患者大腦中澱粉樣蛋白斑塊的水平)毅然批准aducanumab上市。FDA要求Biogen在2030年之前確認該抗體的臨床療效。
分析師仍預計Biogen到2027年的銷售額將達到41億美元。但是銷售開始放緩,美國的一些治療中心拒絕對這一藥物開具處方。Biogen最初將aducanumab定價為每年5.6萬美元,但後來減半。歐洲監管機構拒絕批准該抗體,日本監管機構似乎也將拒絕。該產品的商業成功將取決於美國65歲及以上人群的國家醫療保險計劃(Medicare)是否覆蓋該產品。決定草案將於明年1月出爐。
2022年還會有兩款抗澱粉樣蛋白抗體問世。Biogen和合作夥伴衛材已透過加速批准通道向FDA滾動提交了抗澱粉樣蛋白β (Aβ)原纖維抗體lecanemab (BAN2401)的BLA申請。禮來也正在完成donanemab的提交,並希望在2023年獲得確證性試驗證據。
其他重大獲批事件
隨著諾華/Alnylam的inclisiran獲得批准,第4款基於SiRNA的藥物已經問市。這款藥物利用RNA干擾來減少靶標的表達。
Inclisiran透過抑制PCSK9以降低低密度脂蛋白膽固醇。FDA於2015年批准了兩款靶向PCSK9的抗體——再生元/賽諾菲的alirocumab和安進的 evolocumab——用於心血管疾病風險增加的患者亞群,但這兩款產品尚未達到重磅炸彈的銷售預期。Inclisiran的用藥的便利性可能有助於它具有更好的市場表現。單抗類每2-4 周給藥一次,而inclisiran僅需每年給藥兩次。
如果FDA在2022年批准Anlyam的vutrisiran,這將是多年來RNAi的第5項批准。
憑藉first in class ANGPTL3單抗evinacumab,再生元在心血管領域再創第一。再生元於2017年在動脈粥樣硬化性心血管疾病中對該靶點進行了基因驗證。evinacumab目前已獲批治療純合子家族性高膽固醇血癥 (HoFH) ,HoFH是一種以極高水平LDL膽固醇為特徵的遺傳性疾病。evinacumab預防急性胰腺炎的III期試驗正在進行中。
AstraZeneca/Amgen的tezepelumab是一款治療重度哮喘的first in class TSLP單抗。TSLP是一種IL-7樣細胞因子,可調節多種炎症級聯反應,並可引發與肺部疾病相關的過敏性、嗜酸性粒細胞和其他形式的炎症。Tezepelumab是唯一被批准用於治療重度哮喘的生物製劑,其標籤上沒有任何表型或生物標誌物限制。分析師預測,到2027年tezepelumab的銷售額將達到14億美元。
阿斯利康的anfrolumab是10年來首個獲批治療系統性紅斑狼瘡(SLE)的新藥。許多SLE患者I型干擾素水平升高,Anifrolumab透過與I型干擾素受體結合來阻斷這些細胞因子的活性。
Apellis的pegcetacoplan是首個獲得批准的補體蛋白C3抑制劑,pegcetacoplan是一種合成的限制性環肽,用於陣發性夜間血紅蛋白尿症,這是一種罕見且可能致命的血液疾病。
ChemoCentryx的avacopan於2021年獲FDA批准用於ANCA相關血管炎,是首個獲得批准的補體5a受體拮抗劑。
儘管COVID-19 疫苗、抗體和抗病毒藥物的批准,證實了藥品開發商在壓力下的快速行動速度。但武田的maribavir提供了一個反例。該抗病毒藥物的 I 期資料於1996年首次公佈。從經歷取消優先資格、對外轉讓、失敗的III期試驗以及兩次公司收購中倖存下來後,這款抗病毒藥物終於在今年被批准用於治療鉅細胞病毒 (CMV) 感染。
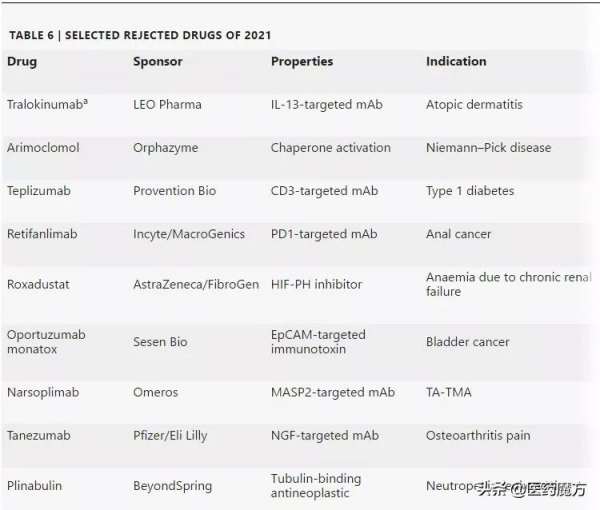
首次遞交遭到FDA拒絕批准的新藥
FDA去年也拒絕了多項上市申請。其中一些可能很快就會重新提交給FDA審查。例如,Provention Bio正在努力重新提交其CD3單抗teplizumab,用於延遲高危人群的1型糖尿病。Teplizumab於1997年首次用於移植排斥的臨床試驗,並引領了一系列針對自身免疫性疾病的T細胞調節療法。
上市申請首次遭FDA拒絕的新藥
a:2021年年底獲批
有些被FDA拒絕的新藥已經終止開發。在FDA釋出了tanezumab用於治療骨關節炎疼痛的完整回覆函後,輝瑞/禮來終止了這款靶向NGF單抗的開發。在III期研究資料顯示這些止痛藥可能導致關節破壞後,FDA曾在2010年將一度有希望的抗NGF類藥物擱置臨床。