近日安斯泰來(Astellas Pharma)和Seagen聯合開發的ADC藥物PADCEV(enfortumab vedotin)再傳好訊息,已於12月17日獲得歐盟CHMP的積極評審意見,預期即將在歐洲獲批用於治療。這將是首個在歐洲獲批用於已接受鉑類和一種PD-(L)1抑制劑治療後的晚期轉移性尿路上皮癌的藥物。
早在2019年12月,Padcev就獲得了美國FDA加速批准用於先前已接受一種PD-(L)1抑制劑、並且在新輔助/輔助治療或在區域性晚期或轉移性疾病治療中已接受了一種含鉑化療方案的區域性晚期或轉移性尿路上皮癌成人患者。2021年2月,安斯泰來與西雅圖遺傳學公司向美國FDA提交了2份補充生物製品許可申請,其中一份也是基於EV-301試驗的資料,旨在將Padcev由加速批准轉變為常規批准。
此次CHMP的積極意見是基於該候選產品全球3期臨床試驗EV-301的資料,將Padcev與化療進行療效比對,主要終點為總生存期。資料的中位隨訪時間為11.1個月。結果顯示,enfortumab vedotin組的總生存期長於對照組(12.88個月 vs. 8.97個月;死亡風險比為0.70;P=0.001)。試驗組的無進展生存期也長於化療組(5.55個月 vs. 3.71個月,P<0.001)。兩組治療相關不良事件的發生率相似(試驗組為93.9%,對照組為91.8%);兩組中3級或更高級別不良事件的發生率也相似(51.4% vs. 49.8%)。
未來可期的靶點Nectin-4
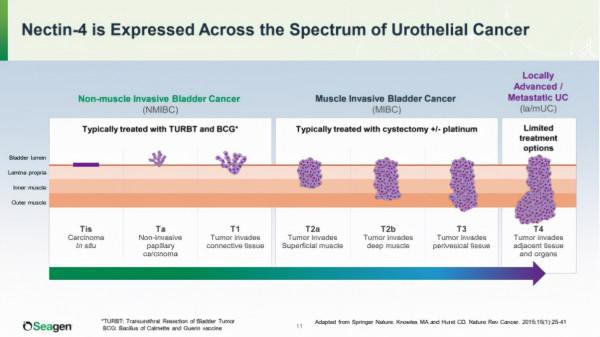
Nectin-4(基因名為PVRL4,脊髓灰質炎病毒受體4)作為一種I型膜蛋白,只特異性表達於胚胎,胎盤以及腫瘤細胞中;尿路上皮癌細胞上高表達,部分乳腺癌、肺癌、胃癌、頭頸癌上高表達,透過啟用P13K/Akt通路促進腫瘤的增殖和遷移。基於靶點的分佈特點,Seagen/安斯泰來選擇從晚期尿路上皮癌入手,穩紮穩打,從晚期後線逐步向前線推進,並拓展到疾病的早期階段——MIBC與NMIBC。
來源:Seagen R&D Day Presentation, 2020年11月
但該靶點的空間不僅於此。Padcev目前共登記了21項臨床研究。除在尿路上皮癌領域廣泛佈局以外,另有兩項值得關注的研究:2020年3月9日啟動的一項II期研究(NCT04225117),探索enfortumab vedotin在多種晚期實體瘤中的有效性和安全性,包括非小細胞肺癌、乳腺癌、頭頸癌、食管癌等;以及2021年11月2日啟動的ENCORE研究(NCT04754191),探索enfortumab vedotin作為單一療法治療轉移性去勢抵抗性前列腺癌。可以想象一旦適應症擴充套件到尿路上皮癌以外的其他實體瘤,市場空間將倍數級增長。
就在3周前,歐洲生物製藥公司Emergence Therapeutics僅以單個早期專案完成8700萬歐元A輪融資的新聞受到廣泛關注。Emergence目前的管線中應只有這唯一一款靶向Nectin-4的ADC藥物ETx-22。構成ETx-22的三個部件,包括抗體、毒素、連線技術,均是由Emergence從3家機構分頭引進(license in),然後自己整合組裝了一款ADC產品,大家驚歎其創新的研發模式同時,也應注意到這也是僅基於一個概念性Netin4藥物——計劃2年後IND。該公司公告稱將推進ETx-22的臨床概念驗證,初始開發用於膀胱和三陰性乳腺癌,以及中低Nectin-4表達水平的惡性腫瘤,包括卵巢,頭部和頸部和肺癌。
國內首個Nectin-4初露光芒
放眼全球,Nectin-4這一賽道玩家很有限。獲得臨床准入的專案全球僅有3個,國外除Padcev,還有Bycicle公司開發Nectin-4靶向雙環肽偶聯毒素BT8009,目前處於臨床1/2期階段;國內僅有一個邁威生物研發的Nectin-4 ADC專案9MW2821。Padcev被視為重磅炸彈藥物,而管線卻出現顯著斷層。試分析原因有二:一是ADC自帶門檻。ADC藥物由抗體、linker和毒素組成,單抗,linker,ADC需要分別開發,僅臨床前工作就是開發一個單抗藥物的近3倍。二是Nectin-4靶點初期的光芒隱蔽:尿路上皮癌中美各8萬年新發患者,而到晚期末線的療法受眾患者人群並不多。
邁威生物的9MW2821於2021年10月19日獲得臨床默示許可,即將開展I期研究。根據其招股說明書,9MW2821是基於ADC藥物開發平臺和自動化高通量雜交瘤抗體分子發現平臺開發的一款靶向Nectin-4的ADC新藥。9MW2821結構均一、容易產業化,體外藥效活性、體內代謝性質、初步安全性等方面均顯示其良好的成藥性,在多種動物腫瘤模型中均具有良好的抗腫瘤效果,下一步的臨床試驗將會揭示其臨床價值。參照國際進展,大膽猜測9MW2821作為本靶點的後來者,會選擇“兩條腿走路”的策略,同步推進尿路上皮癌和其他實體瘤癌種。我們期待後續的進展。