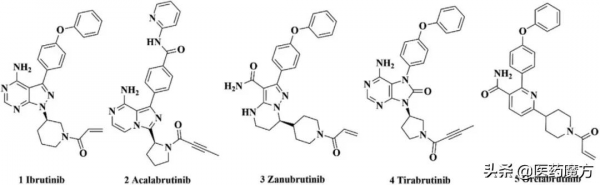
目前上市的5款 BTK抑制劑[1]均為共價抑制劑(圖1),透過共價結合的方式與BTK蛋白激酶域中的C481不可逆結合,達到抑制BTK酶活性的目的。現有的BTK抑制劑(例如依魯替尼和阿卡替尼)在治療BTK依賴性B細胞惡性腫瘤方面有較好的療效。但是,長期使用這些共價型BTK抑制劑後BTK 會產生C481突變(半胱氨酸殘基被絲氨酸殘基取代),並對這些藥物產生獲得性耐藥,進而出現療效減弱。而非共價BTK抑制劑,不與C481產生共價結合,因此C481突變不會導致抑制劑的活性降低,可克服人體對共價BTK抑制劑的耐藥性,此外PROTACS、藥物聯用或多靶點治療也為解決耐藥提供了新的思路[2]。
圖1 批准上市的BTK抑制劑
LOXO-305和禮來
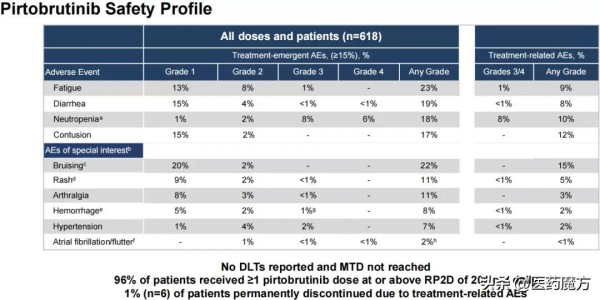
12月12日,禮來和默沙東在第63屆美國血液學會(ASH)年會上公佈了各自口服、高選擇性、非共價可逆BTK C481S抑制劑pirtobrutinib(LOXO-305)和MK-1026在惡性血液腫瘤中的療效資料[3]。驚豔的資料凸顯BTK非共價可逆抑制劑的巨大潛力(圖2)[4]。非共價抑制劑是激酶抑制劑設計的常見方法,競爭性佔據ATP與激酶結合口袋,但與激酶結合後經代謝可脫離,不會對靶蛋白造成不可逆的損害,不易形成耐藥。下文將簡單介紹目前進展最快的LOXO305和臨床在研的BTK可逆抑制劑。
LOXO-305最初由英國一家名為Redx Pharma的公司開發,原名 RXC005,後來該專案被美國 LoxoOncology公司收購,更名為LOXO-305,並於2018年被推入臨床階段。2019 年禮來公司以約80億美元收購了Loxo Oncology,囊括一系列抗癌靶向藥,其中就包括LOXO305[5]。
圖2 Pirtobrutinib部分臨床資料
圖3 推測的LOXO305發現過程
專利WO2017103611披露了包含LOXO305的結構通式,根據伊布替尼的藥效團模型(圖3),包含三個部分,hinge region、H3口袋(疏水口袋)、共價結合區(與481位的半胱氨酸共價結合);把伊布替尼的吡唑並嘧啶胺開環得到吡唑鄰位帶氨基的醯胺,氨基和醯胺透過氫鍵形成一個偽雙環,把H3口袋中氧連線的疏水基團改為醯胺亞甲基連線的芳香環,共價結合區則改成非共價結合的CF3取代的乙基,最終最佳化得到LOXO305。
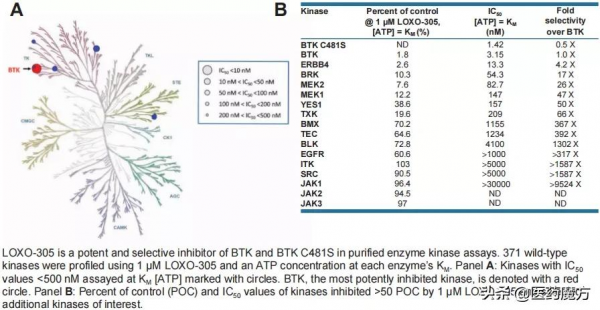
表1 LOXO-305高效、選擇性地抑制BTK和BTK C481S激酶活性
在激酶抑制活性測試中(表1),LOXO-305對371種野生型激酶測試,其對 BTK和C481突變BTK的抑制活性(IC50值)分別為1.42和3.15 nmol/L(高於其他激酶約300倍)。在體外細胞模型(圖4)中,依魯替尼和LOXO-305對HEK293細胞中BTK的抑制活性(IC50值)分別為5.7和8.6 nmol/L。而在C481突變的HEK293細胞中,依魯替尼對HEK293的抑制活性下降到1 μmol/L以上,LOXO-305對BTK的抑制活性仍達到8.8 nmol/L。這說明LOXO-305對BTK的抑制能力基本不受C481突變的影響[6]。
圖4 BTK體外細胞模型
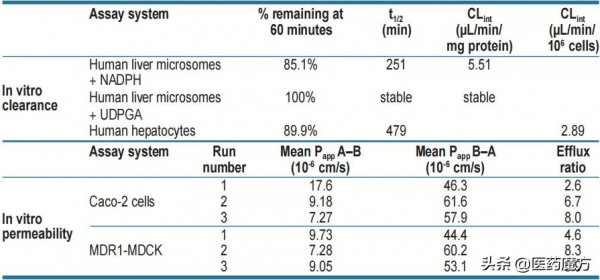
表2 體外實驗中LOXO-305具有低的人肝微粒體清除和高滲透性
表3 動物研究中LOXO-305的藥代動力學
在禁食/未禁食交叉研究中[7],對8只比格犬在第1 天和第8天給予30 mpk的LOXO-305,給藥後48 h採集血樣。結果顯示:禁食組最大血藥濃度(Cmax)為18100 ng/mL,血藥濃度-時間曲線下面積(AUC0~t)為162000 ng·h/ml;未禁食組Cmax為10000 ng/mL,AUC0~t為105000 ng·h·mL-1。另一項實驗中,對4只未禁食的Sprague Dawley大鼠單次給予35mpk 的LOXO-305,給藥後24 h內採集血樣。結果顯示:Cmax為7930 ng/mL,AUC0~t為82200 ng·h·mL-1。表明口服給藥後大鼠和犬的血漿暴露水平較高,預計BTK和BTK C481S靶區覆蓋水平較高。基於人體細胞模型的體外藥物代謝動力學試驗資料見表3,根據體外試驗資料判斷LOXO-305具有較低的人體清除率和較高的滲透性(表3)。此外,臨床試驗 NCT03740529公佈的部分人體藥物代謝動力學資料顯示,患者血液中LOXO-305的暴露量隨給藥劑量增加呈線性增加。[8]
可逆抑制劑有望解決耐藥問題
針對C481突變的臨床在研BTK可逆抑制劑包括共價和非共價兩種形式,如下表所示。
表4 代表性BTK可逆抑制劑[5]
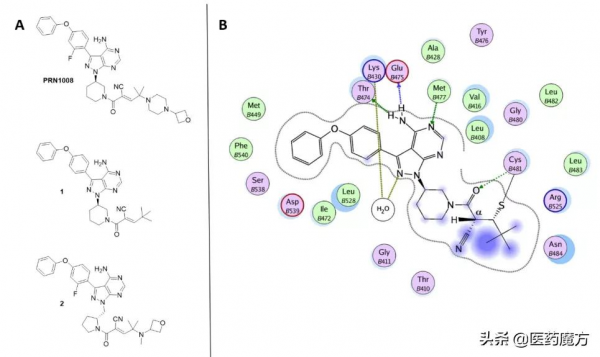
PRN1008和SAR-444727屬於可逆共價抑制劑,結構中的氰基是一大特徵[11]。這類化合物(圖5A)嵌入可逆的氰基丙烯醯胺基親電試劑,透過哌啶或吡咯烷連線到吡唑嘧啶骨架上。氰基丙烯醯胺官能團則連線著具有不同空間位阻和電子性質的烷基或雜烷基,這可以影響可逆抑制劑的residence time[10]。圖5B中的配合物(PDB程式碼4YHF)的晶體結構中,配體與Cys481共價結合,氨基吡咯嘧啶部分與Thr474、Glu475和Met477形成氫鍵。叔丁基遮蔽了Cα上的質子,防止了與Cys481的硫醚鍵斷裂。而氰基的引入使得Cα氫的酸性增強,半胱氨酸的不可逆加成變為可逆加成。可逆共價抑制劑的親電彈頭多為氰基、酮羰基等可逆親核加成反應受體,其與靶標共價結合的可逆性,使得可逆共價抑制劑的藥代動力學特徵介於不可逆共價抑制劑和非共價抑制劑之間。可逆共價抑制劑具有抑制作用時間長、有效濃度低、降低脫靶毒性的優點。
圖5 (A) PRN1008、1和2的化學結構。(B) 氰基化合物1的晶體配合物的Ligplot
CGI-1746是吉利德研發的可逆非共價BTK抑制劑,結構中的叔丁基苯基佔據H3口袋,其吡嗪酮母核與Met477形成2個氫鍵,且吡嗪酮母核醯胺結構的NH與Lys430形成氫鍵,不與Cys481結合,活性較高。但結構中的叔丁基與醯胺在體內易發生羥基化、水解而代謝失活,影響成藥性。羅氏以吡啶酮為母核降低親脂性,引入苯甲醇與F取代的雙環內醯胺得到RN-486,活性增強6倍。Genentech以六氫苯並噻吩代替叔丁基苯基得到GDC-0834,但其分子仍存在不穩定的醯胺鍵,透過醯胺與吡咯關成雙環佔據H3口袋得到GDC-0853,活性提高至0.91 nmol/L。GDC-0853對BTK各突變型細胞株的活性與野生型相當,目前處於臨床三期,體內易代謝和動力學較差仍是其隱患。
BMS的BMS-935177是一類咔唑類分子,IC50為3 nmol/L,毒性研究表明該化合物在多種動物中治療窗較窄。後續BMS-986142的IC50提高至0.5 nmol/L,具有良好的體內安全性,但類風溼性關節炎、乾燥綜合徵的適應症,目前在臨床二期無進展。日本的Carna Biosciences公司把RN-486的吡啶酮經骨架躍遷改成嘧啶胺,後關成吲哚環並在溶劑可及區最佳化片段得到AS1763,目前處於臨床一期,適應症為慢性淋巴細胞白血病。
圖6 GDC0853和RN486的改造思路
ARQ-531(MK-1026)是默克研發的一種有效的ATP 競爭性的,可逆非共價BTK抑制劑,其IC50值為0.39 nmol·L-1,其核心吡咯並嘧啶環與Gly475和Tyr476殘基的鉸鏈主鍊形成雙齒配位的氫鍵;與依魯替尼類似,苯氧基苯基佔據 ATP的疏水口袋,氯原子則位於Ala428和Lys430 側鏈之間;四氫吡喃甲醇的側鏈則暴露在溶液環境,有利於水分子介導的廣泛氫鍵網路。正是由於這個空間因素的限制,ARQ-531無法接近Cys481形成共價鍵[12]。
技術迭代也是創新的一種思路
目前已上市的BTK抑制劑全球銷售規模超過100億美元。其中伊布替尼2020年全球銷售規模達到94.4億美元(2021年前三季度已銷售73.7億美元),屬於史詩級重磅炸彈產品。第一代不可逆 BTK抑制劑依魯替尼目前的適應證包括 MCL、WM、CLL、移植物宿主病等[9]。第二代不可逆BTK抑制劑阿卡替尼和澤布替尼目前臨床獲批的適應證僅有MCL,但它相較於依魯替尼對BTK選擇性更高,因此毒性有所降低,但是因Cys481位點突變引起的耐藥性問題仍然沒有解決。BTK可逆抑制劑的發現有望解決這一問題,它們不依賴481位半胱氨酸結合位點。而LOXO305和ARQ531作為代表性的BTK非共價可逆抑制劑,目前臨床進展最為靠前。
靶點發現嚴重依賴基礎科研,但不代表產業界就沒有發揮空間,企業仍可以在成熟領域持續做技術方面的改進。腫瘤因其內源性和複雜性,腫瘤藥一直是創新藥的珠峰,沒有百分之百滿足的臨床需求,就是未滿足的臨床需求。在新藥開發的思路上,與其捲起來,不如鑽進去。
參考文獻:
1.Tiantai Zhang et al; Emerging small-molecule inhibitors of the Bruton’s tyrosine kinase
(BTK): Current development, European Journal of Medicinal Chemistry 217 (2021) 113329。
2.吳敬德等;應對BTK突變所致耐藥的分子設計策略;中國醫藥工業雜誌2021,52(8)。
3.醫藥魔方Info公眾號;療效驚豔!禮來、默沙東公佈BTKC481S抑制劑最新資料.
4.Wojciech Jurczak etal;Pirtobrutinib, A Highly Selective, Non-covalent (Reversible) BTK Inhibitor In Previously Treated CLL/ SLL: Updated Results From The Phase1/2 BRUIN Study; 2021 ASH ANNUAL MEETING & EXPOSITION;
5.https://clinicaltrials.gov/ct2/home。
6.Loxo Oncology;LOXO-305, a highly selective and non-covalent next generation BTK inhibitor, inhibits diverse BTK C481 substitution mutations;2019 ASH Annual Meeting.
7.Loxo Oncology ; LOXO-305, a next generation non-covalent BTK inhibitor, for overcoming acquired resistance to covalent BTK inhibitors; SOHO Annual Meeting 2018.
8.曹爽等;新一代非共價酪氨酸激酶抑制劑LOXO-305;臨床藥物治療雜誌 2020年11月 第18卷 第11期。
9.Fancui Meng et al; Recent Advances in BTK Inhibitors for the Treatment of Inflammatory and Autoimmune Diseases;Molecules 2021, 26, 4907. https://doi.org/10.3390/molecules26164907.
10.Jack Taunton et al; Prolonged and tunable residence time using reversible covalent kinase inhibitors; Nat Chem Biol. 2015 ; 11(7): 525–531.
11.Andrea Spallarossa et al; Btk Inhibitors: A Medicinal Chemistry and Drug Delivery Perspective; Int. J. Mol. Sci. 2021, 22, 7641.
12.H. Yesid Estupiñán et al;BTK gatekeeper residue variation combined with cysteine 481 substitution causes super-resistance to irreversible inhibitors acalabrutinib, ibrutinib and zanubrutinib; Leukemia (2021) 35:1317–1329.