俗話說,“牙疼不是病,疼起來真要命”,引起廣義上的牙疼的原因有很多種,其中之一就是牙周病,牙齦紅腫或許好解決,但是嚴重的牙周炎會導致牙齒鬆動和脫落,這對生活的質量的影響可大了去了。
雖然科學家們已經知道了嚴重牙周炎是由過度的免疫反應引起的,但這種過度的免疫反應是如何發生的?它又是如何導致牙齦組織和牙槽骨受損的?這些問題都還沒有答案。
在最近的《科學》雜誌上,美國國立牙科和顱面研究所(NIDCR)的研究人員發表了一項新研究[1],他們發現,嚴重牙周炎中過度的免疫反應是由於纖維蛋白沉積在口腔粘膜中,招募並激活中性粒細胞,誘導活性氧(ROS)產生和中性粒細胞外陷阱的形成(NETosis)導致的。抑制纖維蛋白沉積或NETosis可能是治療嚴重牙周炎的關鍵靶點。

纖維蛋白是一種促炎因子,與血栓形成和炎症有關。過去的研究發現,纖維蛋白在口腔黏膜中的病理性沉積會導致嚴重的牙齦組織和牙槽骨的受損,導致青少年整個齒列的缺失[2,3],而齒列周圍的粘膜炎症和牙槽骨損傷正是牙周炎的標誌。
纖維蛋白沉積由纖溶酶負責消除,因此在出現病理性沉積的患者中通常存在纖溶酶的缺失。因此,研究人員做出了假設,即,纖溶酶介導的纖維蛋白溶解的缺失可能是牙周炎患者口腔黏膜過度免疫反應的原因。
為了驗證這個假設,他們開始一系列實驗。
首先,研究人員構建了蛋白纖溶酶原(PLG,纖溶酶的前體)和纖維蛋白原(纖維蛋白的前體)雙缺失的小鼠,和同窩的PLG缺失/纖維蛋白原部分缺失的小鼠相比,前者完全沒有纖維蛋白的沉積,而且,纖維蛋白原缺失也完全避免了PLG缺失會導致的牙槽骨的損傷。這就表明,PLG缺失引起的口腔黏膜過度免疫反應是由纖維蛋白沉積驅動的。

PLG和纖維蛋白原雙缺失小鼠(右下)和同窩PLG缺失/纖維蛋白原部分缺失小纖維蛋白的沉積情況
在PLG缺失,纖維蛋白沉積的小鼠的口腔黏膜(牙齦)組織中,研究人員發現了大量的中性粒細胞,相應的,負責中性粒細胞招募和粒細胞生成的基因、參與中性粒細胞和單核細胞活化的基因表達都大大增加。中性粒細胞的數量不僅在整個病理週期中的每一個時間點都顯著增加,還是唯一一種在病理階段早期(12周)也增加的細胞亞群。
整合素αMβ2是介導中性粒細胞招募的重要分子,整合素家族的成員也在介導細胞間和細胞與細胞外基質間的黏附方面發揮重要作用。實驗顯示,αMβ2介導了中性粒細胞和纖維蛋白的黏附,誘導活性氧(ROS)產生和中性粒細胞外陷阱的形成(NETosis)。

當研究人員透過藥理學或者遺傳學手段抑制了PLG缺失小鼠細胞外DNA和NETosis的積累時,小鼠牙槽骨的損傷顯著減輕。同樣,利用小干擾RNA(siRNA)靶向消除纖維蛋白原後,也顯著減輕了牙槽骨的損傷。
不僅僅是PLG缺失的特殊小鼠,在自然衰老的野生型小鼠中,纖維蛋白無法沉積的小鼠隨年齡增長而自發出現的牙槽骨損傷也明顯比同窩的對照組小鼠要輕。
因此,纖維蛋白沉積和NETosis都是阻止嚴重牙周炎導致的牙槽骨損傷的重要靶點。
研究人員在牙周炎患者的牙齦組織中也發現了同樣高水平的纖維蛋白沉積和中性粒細胞浸潤,而健康人中則幾乎沒有。
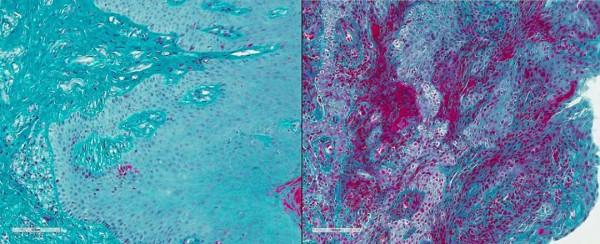
健康人(左)和牙周炎患者(右)牙齦組織中纖維蛋白(紅色)的沉積對比
此前在歐洲進行的全基因組關聯研究曾提出過,PLG(rs1247559)下游多型性與侵襲性牙周炎相關[4,5],研究人員也在他們的牙周炎患者佇列中驗證了這一發現,他們發現,PLG(rs2465836)與嚴重牙周炎和一種牙周炎相關病原體,伴放線菌團聚桿菌的高度定植有關。
也就是說,即使不會導致嚴重的PLG缺失,PLG基因的單核苷酸變異也與嚴重的牙周炎風險增加有關。這也意味著在小鼠中發現的免疫機制可能在人類患者中也同樣適用。
研究的通訊作者之一,Niki Moutsopoulos博士表示,這項研究表明,在某些情況下,纖維蛋白導致中性粒細胞免疫從保護性變為破壞性,這種纖維蛋白-中性粒細胞的相互作是牙周炎的驅動因素之一,因此有望成為嚴重牙周炎的防治靶點,也可能為其他以纖維蛋白沉積為特徵的炎症性疾病,例如部分關節炎和多發性硬化症提供新的治療思路。
參考文獻:
[1]https://www.science.org/doi/10.1126/science.abl5450
[2] Waschulewski I K, Gökbuget A Y, Christiansen N M, et al. Immunohistochemical analysis of the gingiva with periodontitis of type I plasminogen deficiency compared to gingiva with gingivitis and periodontitis and healthy gingiva[J]. Archives of oral biology, 2016, 72: 75-86.
[3] El‐Darouti M, Zayed A A, El‐Kamah G Y, et al. Ligneous conjunctivitis with oral mucous membrane involvement and decreased plasminogen level[J]. Pediatric dermatology, 2009, 26(4): 448-451.
[4] Munz M, Richter G M, Loos B G, et al. Meta-analysis of genome-wide association studies of aggressive and chronic periodontitis identifies two novel risk loci[J]. European Journal of Human Genetics, 2019, 27(1): 102-113.
[5] Schaefer A S, Bochenek G, Jochens A, et al. Genetic evidence for PLASMINOGEN as a shared genetic risk factor of coronary artery disease and periodontitis[J]. Circulation: Cardiovascular Genetics, 2015, 8(1): 159-167.