大家好,今天推送的文章來自於2021年11月發表在Protein Science上的A newly introduced salt bridge cluster improves structural and biophysical properties of de novo TIM barrels,通訊作者是德國拜羅伊特大學生物化學系的Birte Höcker教授。
蛋白質穩定性是一種基本的生物學屬性,它調節蛋白質的可進化性、表達、溶解性、結構和功能之間的微妙平衡。關於微調蛋白質穩定性的指導資訊來自對天然蛋白質的大量研究,並提供了從頭設計蛋白質的可能性。目前已經探索了幾種提高蛋白質穩定性的策略,例如氫鍵網路的重排、鹽橋的引入、疏水核的改進或共價鍵的結合。其中,由於它們高度依賴蛋白質的結構環境和精確幾何形狀的要求,鹽橋的預測和改造工程具有挑戰性。一個鹼性殘基與多個酸性殘基的相互作用形成簇狀或網狀鹽橋對蛋白質穩定性具有重要貢獻,因此特別受關注。
在所有蛋白質結構中,TIM 桶是自然界中最常見的摺疊之一,因為十分之一的已知蛋白質採用這種拓撲結構,並且它存在於七種酶類中的五種中。這種無處不在的多功能拓撲結構具有是研究穩定性、結構和功能關係以及從頭蛋白質設計的重要模型系統。之前,作者證明了在第一個 de novo TIM 桶 sTIM11 中引入疏水性簇會產生了一個高度穩定的 TIM 桶集合,稱之為 DeNovoTIMs。在該研究中,作者探索了將鹽橋簇引入 DeNovoTIM 集合成員時對結構和穩定性的影響。
引入鹽橋簇的效果受到天然 HisF TIM 桶中類似簇的存在的啟發,該簇是咪唑甘油磷酸合酶 (IGPS) 的一個亞基,並觀察到它對穩定該摺疊的影響。由於鹽橋簇旨在在不影響DeNovoTIM 集合中先前穩定區域的情況下進行評估,因此作者專注於桶的內部核心以引入鹽橋網路。作者發現在 TIM 桶的內部核心,特別是在它的底部,4 個與對稱相關的谷氨醯胺殘基適合引入預期的鹽橋叢集。如圖 1所示,四個殘基在四個部分中交替突變為 Arg 和 Glu。

作者在先前報道為 DeNovoTIM 系列的三個不同的 de novo TIM 桶的背景下探索了鹽橋簇的影響,sTIM11noCys,無半胱氨酸變體sTIM11;DeNovoTIM6,在位於 β 鏈外表面和 α 螺旋內表面之間的外圍核心底部區域具有穩定突變;和DeNovoTIM13,在外圍核心的底部和頂部區域具有穩定突變。將鹽橋突變體命名為原始設計加上字尾-SB。
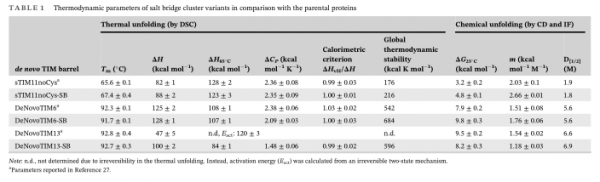
圓二色性 (CD) 分析表明在引入鹽橋簇後沒有大的結構變化,突變體具有與親本蛋白質相似的混合 α/β 二級結構組成。透過熱和化學展開實驗研究了它們的摺疊穩定性行為。CD結果表明sTIM11noCys-SB解鏈溫度(Tm)約為64°C,DeNovoTIM6-SB 和 DeNovoTIM13-SB 在高達 95°C 的可接近溫度範圍內都不會完全展開。透過差示掃描量熱法(DSC)進行進一步分析。與親本蛋白質相比,三個突變體沒有觀察到Tm變化(表 1,圖 2a),但焓 ΔH 有一些變化,主要是 DeNovoTIM13-SB。

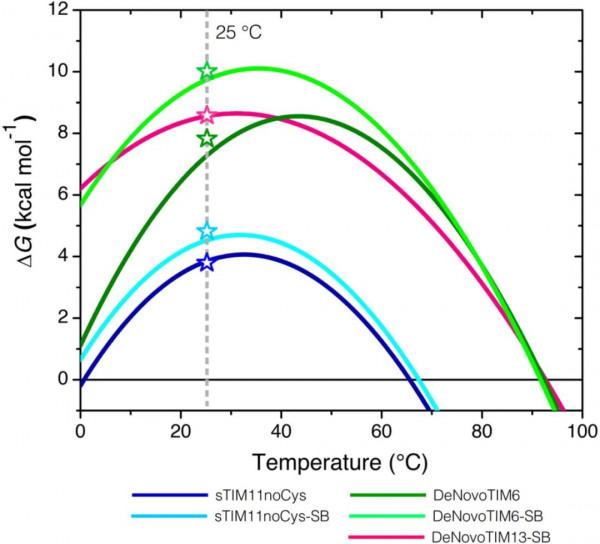
與親本蛋白質相比,鹽橋突變體的熱力學引數沒有重大變化(表 1)。主要區別在於熱容變化 (ΔCP),它在不改變 Tm的情況下重塑了穩定性曲線(圖 3),但增加了 25°C 下的構象穩定性。25°C (ΔG25°C) 時構象穩定性的變化是透過用尿素進行化學解摺疊,然後用 CD 和 IF(內源熒光) 來研究的,其 ΔG25°C 值與熱解摺疊實驗計算的值一致(圖3)。鹽橋突變體與親本蛋白質的比較顯示出不同的趨勢:在 sTIM11noCys-SB 中,鹽橋簇透過在 ΔG25°C 中增加 1.6 kcal mol−1來穩定蛋白質,其中尿素解摺疊中點濃度 (D[1 /2]) 保持不變,但 m 值增加了 0.63 kcal mol−1M−1(表1),表明蛋白質包裝改善了。對於 DeNovoTIM6-SB,觀察到類似的趨勢,但具有更大的穩定效應 1.9 kcal mol-1,由於 m 值增加 0.25 kcal mol-1M-1,導致 ΔG25°C 為 9.8 kcal mol-1。另一方面,在 DeNovoTIM13-SB 中,鹽橋簇似乎使蛋白質稍微不穩定 -1.3 kcal mol-1,導致 ΔG25°C 降低 8.2 kcal mol-1。此外,m 值降低了 -0.36 kcal mol-1M-1,而 D[1/2] 略有增加(表 1)。
之前的幾項研究指出,鹽橋對穩定性的貢獻與其幾何形狀有關,即距離和角度。於是作者解析了突變體的晶體結構,在所有三種蛋白質中都觀察到了不同的鹽橋幾何結構。在 sTIM11noCys-SB 中,形成了一個高度有序的鹽橋簇,與預期的幾何形狀非常相似(圖 4a)。Arg20 顯示了兩種替代構象,提供了兩種不同的鹽橋組。一個構象(Arg20-A)與Glu66形成兩個鹽橋相互作用,與Glu158形成一個鹽橋相互作用替代構象 Arg20-B 類似地與 Glu158 形成兩個鹽橋,與 Glu66 形成一個鹽橋。Arg112 與 Glu66 形成高度協調的side-on鹽橋,並另外與 Glu158 以end-on配置相互作用,在這兩種情況下都透過三種相互作用(表 2)。

在DeNovoTIM6-SB中,四個殘基之間沒有形成簇,僅在 Arg20-Glu66 和 Arg112-Glu158 之間僅觀察到兩個獨立的鹽橋對。在這種單齒backside配置中,精氨酸和穀氨酸之間會發生兩種相互作用(圖 4b)。與sTIM11noCys-SB相比,這種減少的相互作用與這兩種蛋白質的穩定性變化沒有直接關聯,
對於 DeNovoTIM13-SB,在這種涉及水分子的情況下,再次觀察到引入網路的不同配置(圖 4c)。除了單齒直接鹽橋之外,在 Arg20 和 Glu66 之間還形成了雙齒水介導的鹽橋。此外,Arg20 與 Glu158 相互作用,Glu158 也透過單個鹽橋與 Arg112 相互作用。在 Glu66 和 Arg112 之間也形成另一個單鹽橋(表 2)。DeNovoTIM13-SB 構象穩定性的降低表明鹽橋簇可能對拓撲結構產生負面影響。因此,在晶體結構中觀察到的高度協調的鹽橋網路表明在桶的不同區域發生了其他結構重排。考慮到設計 DeNovoTIM13 的方法旨在改善疏水性簇,在 DeNovoTIM13-SB 中分析這些簇的變化作為穩定性降低的可能原因。作者觀察到,與 DeNovoTIM13 相比,DeNovoTIM13-SB 的疏水簇總面積減少了 409 Å2(分別為 5,972 和 6,381 Å2)。故DeNovoTIM13-SB 穩定性降低的一個可能原因是鹽橋簇的引入促進了修飾疏水簇的重排。

鹽橋穩定性的另一個影響因素是其平面性,更高的平面性意味著帶電殘基的更好配位,從而對穩定性有更高的貢獻。對三種不同鹽橋簇的分析顯示 sTIM11noCys-SB 的平面性最高(圖 4a 底部),其次是 DeNovoTIM13-SB,Arg112 略微變形(圖 4C 底部),DeNovoTIM6-SB 的平面性最低,這很可能是由於缺乏形成良好的叢集幾何結構(圖 4b 底部)。
最後,由於鹽橋網路的設計和預測及其相應的穩定性變化具有不確定性,作者測試了在鹽橋變體中觀察到的穩定性變化是否可以透過 Rosetta 評分來預測。由於所涉及殘基的結構良好的幾何形狀的重要性,鹽橋的預測和建模具有挑戰性。使用 Rosetta Remodel 將突變的殘基引入親本蛋白質結構中效果不佳,很少構建完整的網路,並且得分也不是最好的。使用這種設計方法無法生成在 NovoTIM13-SB 中觀察到的涉及水分子的幾何形狀,因為不包含水分子。
為了分析良好放置的鹽橋網路對 Rosetta 評分的影響,使用 Rosetta 中最新和預設的評分函式 ref2015 對鹽橋突變體的晶體結構以及親本蛋白質進行評分。結果顯示 sTIM11noCys-SB 和 DeNovoTIM6-SB 的總分分別降低了 -1.24 和 -1.37 Rosetta 能量單位(REU)。然而,DeNovoTIM6 的得分非常低,每個殘基的總得分為 -0.12 REU,原因是結構解析度低以及相關的模型質量差,包括缺少側鏈。相比之下,DeNovoTIM13-SB 與 DeNovoTIM13 相比,總分提高了 0.23 REU。
大多數從頭蛋白質設計方法缺乏對鹽橋特別是簇的深入設計,儘管它們對穩定性和功能很重要。Rosetta 能夠以正確的趨勢預測對穩定性的影響。儘管如此,在完全自動化的方法中,精確叢集幾何的建模仍然具有挑戰性。不同天然和從頭蛋白質中鹽橋簇的工程和設計將受益於對鹽橋的更好理解。
整理:廖敏
DOI:10.1002/pro.4249
END