出品:新浪財經上市公司研究院
作者:肖恩
近日,天士力釋出關於控股子公司簽署許可協議的公告,稱子公司天士力生物引進Sutro Biopharma(美國)的FRα ADC新藥(酸受體α抗體偶聯藥物)STRO-002的大中華區權益。支付對價為4000萬美元預付款和3.45億美元里程碑金額,以及一定比例的銷售分成。
由於靶向FRα蛋白的目標靶點很明確,因此在相關藥物開發中,目前單抗和小分子進展均較慢,走在前面的反而是ADC。
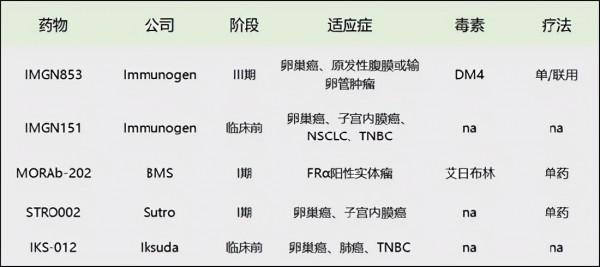
(FRα ADC新藥的臨床進展情況)
衛材的MORAb-202可能成為Best in class,但其亞太的商業化權益已經License out給了BMS,共同開發。而進度最快的ImmunoGen已就Mirvetuximab與華東醫藥達成了約3億美元(4000萬美元預付款+2.65億美元里程碑)的大中華區合作。留給天士力的只有Sutro的STRO-002,但相較於進度相近的潛在BIC對手MORAb-202,STRO-002產品並無明顯優勢,而相較於華東醫藥引進的Mirvetuximab進度明顯落後,且價錢明顯更高。
在醫藥銷售市場素有“第一家吃肉,第二家喝湯”的慣例,即創新藥的頭部效應非常明顯,上市更晚的me too新藥可能和仿製藥差別不大。相比華東醫藥,天士力這錢花的冤枉。
爭相佈局FRα ADC 與BMS、華東醫藥同臺競技
根據WHO國際癌症研究機構(IARC)的GLOBOCAN專案統計,2020年中國新發卵巢癌5.53萬人,死亡3.75萬人。在我國,卵巢癌年死亡率位於女性生殖道惡性腫瘤之首,是嚴重威脅女性健康的惡性腫瘤。
由於卵巢癌發病隱匿,且目前尚缺乏有效早期診斷措施,70%的患者確診時已處於晚期,而絕大部分中晚期卵巢癌患者經含鉑化療兩年後都會出現疾病復發,且最終都會產生鉑耐藥。根據《卵巢惡性腫瘤診斷與治療指南(2021年版)》,對於鉑耐藥型或難治型復發卵巢癌患者,首選非鉑類單藥化療或聯合抗血管生成靶向藥物(貝伐珠單抗、PARP抑制劑等)的聯合化療。
(鉑敏感復發型首選PARP抑制劑維持治療)
但目前卵巢癌高複發率和低治癒率仍然是一項重大挑戰。
化療單藥治療客觀緩解率(ORR)約10%~25%、無進展生存期(PFS)約3-6.5個月,獲益有限。加抗血管生成藥可改善PFS,但總生存率(OS)無顯著改善,如百濟神州帕米帕利對於鉑耐藥卵巢癌患者的ORR提升到了31.6%,中位PFS為6.2個月,但整體仍較低。且入組的是攜有BRCA1/2突變的患者,而BRCA1/2突變在卵巢癌中佔比僅在20%左右,因此PARP抑制劑的覆蓋面仍然有限。
而在卵巢癌、子宮內膜癌、乳腺癌和非小細胞肺癌等腫瘤組織中高表達的FRα靶點具有腫瘤細胞特異性,在正常組織中不表達或者表達量非常低。這成為了不少藥企試圖改善卵巢癌患者預後的新方向。
繼BMS、華東醫藥之後,天士力也拿下了目前進度前三的FRα ADC。
根據協議約定,天士力講可以在區域內(即中國大陸、香港及澳門特別行政區、臺灣地區)獨家開發、註冊、商業化STRO-002,獲得 STRO-002 在區域內的針對卵巢癌、非小細胞肺癌、三陰性乳腺癌以及其他適應症獨家開發和商業化權益。天士力生物將向Sutro支付4000萬美元首付款和潛在最高3.45億美元的開發及商業化里程碑付款,以及約定比例的銷售額提成。
與華東醫藥的Mirvetuximab資料接近 但進度慢幾拍
華東醫藥在2020年10月引進的Mirvetuximab,用於治療卵巢癌的註冊臨床SORAYA達到主要終點,確認的客觀緩解率為32.4%,中位緩解持續時間為5.9個月。
STRO-002在歐美開展針對復發卵巢癌和子宮內膜癌的一期臨床研究初步療效為:31例可評估患者中,1例完全反應(CR),9例部分反應(PR),緩解率大約在32.2%;所有患者的mPFS為7.2個月,確認應答患者的mDOR為5.8個月。
由於FRα在76%-89%的上皮卵巢癌中高度表達,因此STRO-002儘管不區分患者FRα表達水平入組,但與Mirvetuximab目標患者基本差別不大。
對比奧拉帕利、帕米帕利可見,FRα ADC資料並不明顯好於PARP抑制劑。ADC的研發、生產成本確實要明顯高於小分子口服的PARP抑制劑的,因此,對於BRCA1/2突變的換患者說,優先選擇PARP抑制劑應該更合理。
STRO-002與華東醫藥的Mirvetuximab資料接近,但進度卻慢了很多。目前STRO-002在歐美開展針對復發卵巢癌和子宮內膜癌適應症還僅僅處在一期臨床,而子宮內膜癌的劑量擴充套件研究仍在招募患者的階段。此外和貝伐珠單抗聯用治療復發卵巢癌的臨床研究,葉酸受體α表達陽性的三陰性乳腺癌和NSCLC等,均在探討可行性的階段。
而華東醫藥引進的Mirvetuximab的3期臨床已達到主要研究終點,預計 2022 年第一季度在美國遞交 IMGN853 的生物製品許可申請(BLA)。
而在中國橋接實驗也在進行之中,IMGN853的中國首個臨床試驗申請在2021年3月獲得NMPA批准,目前已經啟動一項國際多中心Ⅲ期研究和一項評價中國成人患者中的安全性、耐受性和藥代動力學的Ⅰ期研究。
(IMGN853的臨床進展情況)
華東醫藥正在積極推動IMGN853臨床準備工作,計劃在2021年12月完成首例受試者入組。
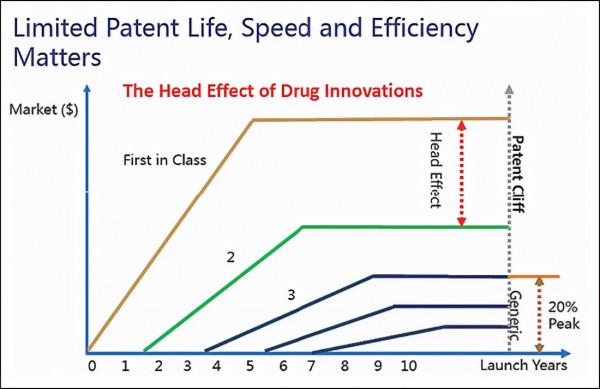
相較於銷售實力強勁的華東醫藥慢了好幾拍,這對於天士力來說可不是一個好訊息。在醫藥銷售市場素有“第一家吃肉,第二家喝湯”的慣例,即創新藥的頭部效應非常明顯,智慧財產權的保護只有20年的時間,在有限的專利期內,更快更早的在更多的國家上市才能更大限度地攫取商業價值,上市更晚的me too新藥可能和仿製藥差別不大。
(創新藥的頭部效應明顯)
相比華東醫藥 天士力這錢花的冤枉
2020年10月,華東醫藥引進Mirvetuximab的大中華區權益,支付對價為4000萬美元預付款+2.65億美元里程碑金額,以及一定比例的銷售分成,彼時Mirvetuximab已在三期臨床階段。
2021年12月,天士力生物引進Sutro的STRO-002的大中華區權益。支付對價為4000萬美元預付款+3.45億美元里程碑金額,以及一定比例的銷售分成,此時STRO-002僅處在1期臨床階段。
對於資料接近的兩個產品,華東醫藥少花了近1億美金,卻獲得了確定性更高的三期臨床產品,且全部的臨床開發及商業化權益。而天士力則僅僅獲得了確定性差的1期臨床產品,在考慮到創新藥的頭部效應,天士力這筆BD價效比明顯要低很多。
此外,進度相同的BMS已在美國和日本進行1臨床試驗,憑藉BMS的臨床資源和經驗,或許在國內甚至也可能走在天士力之前。