在基因表達調控的研究中,報告基因廣泛應用,如熒光蛋白、真核抗性和熒光素酶等。今天小編主要為大家簡述一下熒光素酶報告基因系統,熒光素酶的種類很多,其中應用較為廣泛的是螢火蟲熒光素酶(Firefly luciferase,FLUC)和海腎熒光素酶(Renilla luciferase,RLUC)。
(一)熒光素酶介紹
1. 螢火蟲熒光素酶
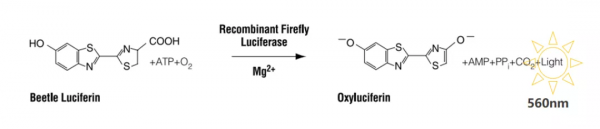
螢火蟲熒光素酶催化的發光反應原理為在ATP、Mg2+和O2存在的條件下,蟲熒光素在蟲熒光素酶的催化下氧化發光,發光顏色為黃綠色。
螢火蟲熒光素酶一般是作為主報告基因,將目的基因構建在該載體上,從而反應目的序列的作用結果,因此根據我們的實驗目的,可以針對此質粒進行改造,載體的工作原理如下圖所示:
2. 海腎熒光素酶
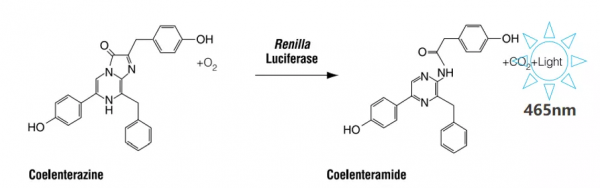
海腎熒光素酶催化的發光反應需要腔腸素和O2的參與,發光顏色為藍色。
海腎熒光素酶通常作為內參報告基因,在實驗操作的過程中,常遇到由於個人操作造成的實驗誤差,比如細胞數目不均一、細胞代次不統一、轉染效率不一致等。引入一個內參報告基因,以此來標定檢測用報告基因的測量結果,從而達到有效地減少實驗誤差的目的,載體的工作原理如下圖所示:
(二)雙熒光素酶報告系統
Dual-Luciferase雙螢光素酶報告基因檢測系統在細胞中同時表達螢火蟲螢光素酶和海腎螢光素酶,兩者沒有種源同源性並對應不同的反應底物,故而沒有交叉干擾。以Luciferase為核心,構建研究物件到相應位置,轉染細胞,裂解細胞,分別加熒光素酶底物,用熒光測定儀檢測熒光強度,透過資料得出基因表達量,從而確定構建序列的功能。雙報告基因則透過共轉染的“對照”作為內參為試驗提供一基準線,從而可以在最大程度上減小細胞活性和轉染效率等外在因素對實驗的影響,使得資料結果更為可信。
(三)實驗流程
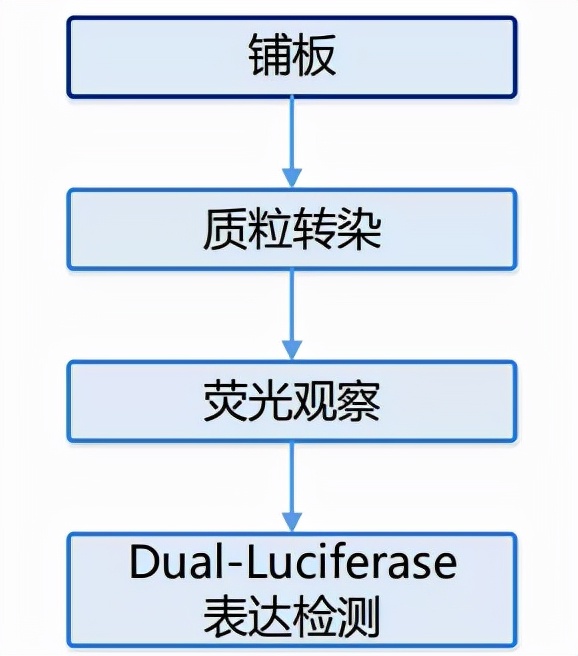
1. 實驗步驟流程
2. 具體實驗步驟
(1)目的細胞準備:
a) 細胞培養:生長 90%匯合的細胞進行傳代培養。
b)細胞鋪板:取對數生長期的細胞製成細胞懸液,計數,接種於 24-well 培養板中(細胞數約為105,具體根據細胞形態大小而定)。37℃、5% CO2培養箱培養至細胞融合度達到約 60%。
(2)目的細胞質粒轉染(以miRNA-靶基因驗證為例):
a) 按照轉染試劑要求將報告基因質粒與轉錄因子表達質粒共轉染細胞,參考實驗分組排布如下圖所示:
(四)應用方向
雙熒光素酶報告系統最常見的應用方向主要有兩種:
1. 轉錄因子-啟動子
啟動子能活化RNA聚合酶,使之與模板DNA準確地相結合並具有轉錄起始的特異性;轉錄因子(TFs)調節基因表達,保證目的基因以特定的強度在特定的時間與空間表達的蛋白質分子。將啟動子區域序列插入到報告基因載體(常用載體為pGL3-Basic Vector,將待檢測的啟動子序列構建在報告基因上游),同時在細胞實驗中共表達轉錄因子,分析熒光素酶表達水平,反應轉錄因子是否影響基因表達情況。
(1)實驗分組參考
|
分組序號 |
分組名稱 |
|
實驗組 1 |
Promoter-NC+TFs-NC |
|
實驗組 2 |
Promoter-NC+TFs |
|
實驗組 3 |
Promoter +TFs-NC |
|
實驗組 4 |
Promoter+TFs |
(2)資料處理
啟動子活性檢測的資料處理比較簡單,將同一樣品孔內Firefly Luciferase值與Renilla Luciferase值的比值Firefly /Renilla luminescence作為luciferase相對錶達量
(3)資料分析
透過熒光值對比確定哪一區域為核心區,luciferase表達強度顯著降低說明轉錄因子能抑制啟動子的啟動能力。
2. miRNA-靶基因
3‘UTR是位於編碼基因終止密碼子下游延伸至多聚A尾巴(Poly-A)的前端,透過自身結構或者與其他分子相互作用調控基因表達,miRNA大部分透過成熟體種子區與3’UTR結合抑制蛋白翻譯。將待驗證序列插入到報告基因載體的3‘UTR區域,再共轉入microRNA,如果熒光素酶表達下降,則待驗證序列是miRNA靶序列。
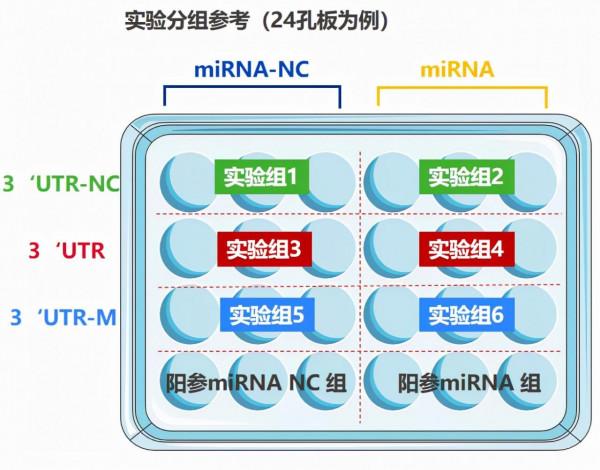
(1)實驗分組參考
|
分組序號 |
分組名稱 |
分組情況說明 |
|
實驗組1 |
3’UTR-NC+ miRNA-NC |
靶基因3’UTR陰性對照質粒與microRNA(陰性對照)及其對照質粒(實驗體系對照)共轉 |
|
實驗組2 |
3’UTR-NC+miRNA |
|
|
實驗組3 |
3’UTR+miRNA-NC |
野生型靶基因3’UTR質粒分別與microRNA及其對照質粒共轉染(目的實驗組) |
|
實驗組4 |
3’UTR+miRNA |
|
|
實驗組5 |
3’UTR-MU+ miRNA-NC |
靶基因3’UTR質粒序列進行突變,分別與microRNA及其對照質粒共轉(與實驗組4進行比較,進一步驗證) |
|
實驗組6 |
3’UTR-MU+ miRNA |
|
|
陽參miRNA NC組 |
陽參3' UTR + miRNA-NC |
|
|
陽參miRNA組 |
陽參3' UTR + 陽參miRNA |
|
(2)檢測體系中各質粒名稱說明
|
miRNA-NC |
microRNA空載質粒,作為目的microRNA質粒陰性對照 |
|
miRNA |
microRNA載體質粒,表達目的microRNA |
|
3' UTR-NC |
3' UTR空載質粒,作為靶基因3' UTR質粒陰性對照 |
|
3' UTR |
靶基因3' UTR質粒 |
|
3' UTR-MU |
靶基因3' UTR突變體質粒 |
(3)資料處理
a) Firefly /Renilla luminescence:同一樣品孔內Firefly Luciferase值與Renilla Luciferase值的比值,代表luciferase相對錶達量(消除操作誤差)。
b)Firefly /Renilla luminescence fold change:同一Luciferase質粒轉染的兩個組中,將miRNA-NC組luciferase相對錶達量均一化為1,目的miRNA組相比miRNA-NC組後,其luciferase相對錶達量(消除在3' UTR空載體質粒下,miRNA質粒和miRNA NC質粒造成的誤差,該誤差在20%範圍內屬於正常情況)。
c)Normalized fold change:將UTR-NC組量化為1後,比較在相同的miRNA的作用下,UTR組和UTR突變組的luciferase相對錶達量。
(4)結果分析
是不是很複雜,結果看不懂?不用害怕,很多組都只是對照而已,真正要看的關鍵資料是第4組和第6組的資料,記住這句話:第4組資料死命低,其他各組資料差不多你就贏了!
(五)常見問題及解決方法
Q1:關於熒光的問題-熒光值過高
熒光值過高可能會超出儀器檢測範圍,從而檢測不到值,一般讀數在5-6位之間較好。熒光值過高可透過以下方式嘗試解決:
1.減少質粒轉染量;
2.細胞樣品裂解後,離心取上清後檢測或對裂解產物進行稀釋後檢測。
(注:不建議透過減少底物量來降低熒光值,需要保證底物的飽和來反映熒光素酶真實的表達水平,否則會造成檢測結果出現大的偏差。)
Q2:關於熒光的問題-熒光值過低或無熒光值
1. 啟動子活性低
a.最佳化細胞的培養條件,提高熒光素酶的表達量;
b.更換強啟動子(如SV40、CMV)。
2. 轉染效率低
a.最佳化轉染實驗條件,用較易轉染的質粒做陽性對照(如轉染過表達熒光蛋白質粒);
b.確保轉染DNA的質量,可透過酶切或瓊脂糖凝膠電泳的方法對DNA質量進行鑑定;
c.選擇活性較高,處於指數分裂期的細胞進行轉染。
3. 樣品裂解效率低
a.細胞培養時間不宜過長,12-36h內最好,長時間培養後,細胞可能會難裂解;
b.加入的裂解液需足量,保證細胞能夠充分裂解。
4. 熒光訊號衰減
熒光素酶的半衰期一般約30min,加完底物後可立即檢測,儘量在30min內完成。
5. 底物氧化失效
a.底物避光密封儲存,螢火蟲熒光素酶底物-20℃儲存;海腎熒光素酶底物推薦-80℃儲存;
b. 反應工作液建議現用現配。
Q3:如何判斷實驗體系無異常,獲得客觀的實驗結果?
可以從以下幾個方面來考察實驗結果的客觀性:
1. 對照的2個實驗組,即實驗組1與實驗組2 luc表達情況應無顯著差異;
2. 轉染正常,質粒或mimic確保成功轉染入細胞;
3. luc檢測值在儀器檢測線性範圍內。
Q4:如何判斷轉染成功?
1. 如轉入的miRNA帶熒游標記如GFP,則可直接在轉染後、細胞裂解前,顯微鏡下觀察細胞熒光;
2. 如轉入的miRNA不帶任何熒游標記,可考慮進行miRNA的qRT-PCR檢測,透過檢測結果判斷實驗組2、4、6是否相對其對照組miRNA有顯著過表達;
3.設定一個熒光質粒轉染參照組,同批轉染一個組的細胞,間接反映出同批次實驗的轉染情況。