基石藥業1月3日早間在港交所公告,其CS5001的臨床試驗申請(“IND”)已獲得美國食品藥品監督管理局(FDA)的試驗可以進行(“SMP”)的通知信函。這是一款潛在全球同類最佳抗體偶聯藥物(“ADC”),靶向受體酪氨酸激酶樣孤兒受體1。CS5001利用定向偶聯技術獲得精準的藥物抗體比率(“DAR”)數值為2,便於實現均質生產及大規模生產。
sponsored links
基石藥業:CS5001的臨床試驗申請獲美國FDA批准
分類: 健身
時間: 2022-01-02
相關文章
人到中年,開始養生,開貼記錄站樁歷程(第873天)
第873天,晚上45分鐘. 今晚站樁剛開始有點散亂,從狀態到氣息,並且身體左右兩側都不平衡,右高左低,慢慢的腰胯松沉下來之後,左右兩側也慢慢平衡下來了,身體也出現了之前沒有的上下連通,挺拔高大的感覺, ...
人到中年,開始養生,開貼記錄站樁歷程(第896天)
第896天,晚上40分鐘. 今晚沒什麼感覺,昨晚打羽毛球的反應出來了,右手臂痠痛,屁股和腰也是痠痛,站樁能做到松沉,但維持不住,好不容易堅持到40分鐘就下樁休息. 今天帶孩子去徒步,一會爬山一會下谷, ...
人到中年,開始養生,開貼記錄站樁歷程(第897天)
第897天,晚上疲勞,休息. 這個疲勞不是一般的疲勞,是非常疲勞,累到呼吸都費勁的感覺,再加上胳膊疼.屁股疼,所以停站,休息.
人到中年,開始養生,開貼記錄站樁歷程(第899天)
第899天,晚上50分鐘. 狀態一般,正常的身體狀態,沒有特別反應,感覺身體兩側又開始有點不平衡,總感覺骨盆是側著的,很彆扭,但低頭看下,又是正的,我老婆最近一直說我左肩高右肩低,我想這跟我之前腰椎間 ...

我,54歲,福建人,做生意欠了1500萬,迫於無奈,只能當保姆還債
這是我們講述的第20位真人故事 口述丨項姐 撰文丨噹噹 我是項姐@保姆項姐,福建人,一個50多歲的退休阿姨,生意失敗欠下1500萬外債.現在選擇就業重頭再來,從零開始.賺錢還債,餘生最大的願望是還清欠 ...

搬新家後改造的第一步,深度體驗華為智選VOC智慧門鎖S
1. 前言 千呼萬喚始出來,一直研究各種品牌的智慧鎖.尤其是我家那位逛商場看到智慧鎖的展示臺就嘀咕,什麼時候能換一個智慧鎖嘗試一下,科技在進步,不帶鑰匙的斷舍離,是一種人類迴歸自然的現象. 為了滿足我 ...
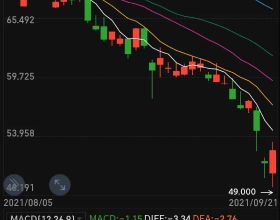
2021年9月22日股市早評
一:大盤分析: 9月17日 上證指數:上證指數盤中震盪,但沒有突破盤中高點,在過中秋節,過成了中秋劫了,預估開盤低開 ,最低能達到3535點,最近風險大,長線等待,等待買點.也不用太悲觀. 深成指:衝 ...

因為戰力太強,這5個人常被誤認為是開國上將,但軍銜其實是中將
1955年9月27日下午5時,金秋時節的北京,首次授銜儀式隆重舉行.部分將領後在1956年.1958年授銜,總的算起來首次授銜的開國將領一共是1614位.其中10位元帥.10位大將.57位上將.177 ...
相比普通操作方式,真觸控式螢幕青稞智慧鎖何以“出圈”?
每次家裡換阿姨的時候,你是否遇到過這種煩惱,門鎖授權太多,搞不清楚哪個是阿姨的,只能一股腦全部刪除再重新錄入使用者資訊,錄入過程繁瑣不說,還極度考驗主人耐心! 但是,只要您擁有青稞智慧鎖,這些煩惱一鍵 ...
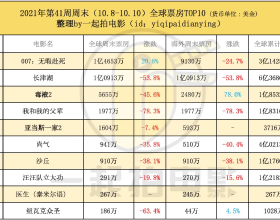
《無暇赴死》1.46億美元反超《長津湖》取得全球周冠
作者 / 打打 在漫威和福斯的幫助下,迪士尼公司年度全球累計票房已經在本週一突破20億美元,在後疫情時代已經有7部影片破億無愧好萊塢一哥的地位,其中正在熱映的<尚氣>超過4億美元成為今年票 ...
國足問題在哪?
國足的問題在於不懂用人,不懂揚長避短!在個人技術差.體能不足.缺失信心的情況下,腳底跟灌鉛了似的,邁不開步.站樁式傳球,接球,防守形同虛設.大家可以回想一下前幾年恆大亞冠奪冠的時候,那時中場有個能控球 ...

開獎6.2斤米奇,破水到出生,順產全記錄
我的順產日記: 弟弟♂️,6.2斤,自然分娩, 分娩日期:5月6日10:30分 產程第一階段--開指 護士會抽血量體溫血壓等,每隔一段時間做內檢檢查開指情況,這裡會用到成人紙尿褲,護士還會給到消毒好 ...

姚宗勳說樁功練法,高人指點才知道,原來站樁如此簡單
當初我學的時候,因為有我們師兄在那兒,我也能證明我的話,我們老師教人的時候,他讓你一下子都會了,不讓你做區域性,因為我比較笨,當初我練的時候,我那麼做不到,我自己沒敢跟老師說,我就把它切開了,我是這麼 ...

祖傳體弱,一生多病,蘇東坡的養生秘方有用嗎?
因病得閒殊不惡, 安心是藥更無方. 這是蘇東坡在詩中寫下的話,意思是休病假挺好,安心乃最好的藥,體現出他的曠達.據學者彭文良鉤沉,蘇東坡一生多病,患有眼病.肩痛引發左手偏癱.耳聾.痔瘡.肺病.頭痛.牙 ...

站樁:拉著站是關鍵
站樁的首要要求,就是對姿勢的要求,而且這些對姿勢的要求,哪怕以現代科學看來,都是那麼的符合人體自然規律,有利於人體氣血的執行. 鍛鍊的大原則,那就是松.靜.自然. 唯有松靜了,五勞七傷的可能性才能降到 ...

“丑角”巨興茂:從無名配角到億萬名導的心酸歷程
"丑角"巨興茂:從無名配角到億萬名導的心酸歷程 1981年6月26日,山西晉中左權縣的一戶農家,誕下了一個男嬰. 父親為他起名巨興茂,希望他的生活欣欣向榮. 沒有人會想到,這個嬰兒 ...

散文:人到中年,在經歷中慢慢學會沉默
作者:子墨 流年陌上,轉眼是秋,時光荏苒,季節往復,寂靜中歲月沉澱出詩意的秋色,讓人感慨萬千. 黑塞<德米安> :"我們來自同一個深淵,然而人人都在奔向自己的目的地,試圖 ...

人到中年,看淡一切
作家白落梅說: "世間諸法無常,看淡一切,迴歸自然,方是徹悟,方為乾淨." 浮生一夢,幾度清歡. 人到中年,看淡得失,放下名利,獨處閒情. 看淡關係,獨來獨往 <孤獨力> ...

明定陵開棺全紀實:一帝二後皆剩骨架,陪葬寶物令人驚歎
1957年的秋天,考古隊員歷時一年多,終於如願打開了地宮入口,並一路探到地宮深處,尋找到了萬曆皇帝和皇后的棺槨所在. 這是新中國第一次以考古的形式發掘帝王陵墓.當考古隊面對三口巨大的棺槨,和整整26箱 ...

