小細胞肺癌(SCLC)佔肺癌的13%-15%。
SCLC因具有強大的侵襲性(其倍增時間快且易於早期傳播)導致80%-85%的患者被診斷為廣泛性疾病,且5年總生存率(OS)僅為5%-6%。
SCLC最初對化療和放療具有高度敏感性,但後期普遍出現治療耐藥,尤其是復發後缺乏有效的後續治療導致患者的預後不佳。
臨床上迫切需要闡明SCLC治療耐藥的機制。近日,中山大學腫瘤防治中心陳明教授
研究團隊透過比較治療敏感型和耐藥型SCLC腫瘤樣本的基因型和表型,探討了SCLC治療耐藥的機制,該研究結果發表於
Clinical cancer research(IF=12.531)。
研究背景
在過去的三十年裡,鉑類雙藥化療一直是SCLC的主要治療方式。同步放化療(CCRT)仍然是侷限期(LS)-SCLC的治療標準。最近,靶向程式性死亡受體-配體1(PD-L1)的免疫檢查點抑制劑已成為與化療聯合作為廣泛期(ES)-SCLC患者一線標準治療。SCLC最初對化療和放療具有高度敏感性,但後期普遍出現治療耐藥,尤其是復發後缺乏有效的後續治療導致患者的預後不佳。儘管對侷限期疾病的放療和廣泛期疾病的增加了免疫療法,但復發通常是不可避免的。因此,迫切需要闡明SCLC治療耐藥的機制。最近,一項使用全外顯子組測序(WES)的研究顯示WNT訊號啟用可能是SCLC治療失敗的機制,但是迄今為止還沒有針對亞洲患者的類似研究。
來自中國科學院大學附屬腫瘤醫院(浙江腫瘤醫院)陳明教授研究團隊透過比較治療敏感型和耐藥型SCLC腫瘤樣本的基因型和表型,探索了SCLC治療耐藥的機制。透過對11例接受CCRT治療的LS-SCLC的初診和復發的腫瘤樣本進行了WES。對9名接受CCRT治療的LS-SCLC患者在正常水平和復發時獲得的遊離DNA(cfDNA)進行了1,021個癌症相關基因的靶向測序。此外還對來自28名化療耐藥和23名化療敏感ES-SCLC患者的福爾馬林固定石蠟包埋(FFPE)腫瘤樣本進行了基於無標記質譜的蛋白質組學。最後,他們透過分析來自公共資料庫的具有不同治療敏感性的SCLC細胞系的轉錄組資料和對化療耐藥和化療敏感的SCLC細胞系進行體外研究來進一步驗證他們的發現。
放化療後的基因組變化富集在PI3K/AKT通路
首先對初治與復發的SCLC腫瘤的基因組譜進行比較,確定與CCRT後復發相關的基因組。在所有患者的2827個突變中,基線和復發樣本共同擁有有1997個突變(圖1A)。圖1B顯示了每個患者共享的、治療初治的特異性突變(在初次診斷時存在,但在復發時不存在)和復發特異性突變(在復發時存在,但在初次診斷時不存在)的百分比。我們觀察到初治和複發性SCLC腫瘤之間共有71%(範圍從39%-94%)的突變,與非小細胞肺癌(NSCLC)相似,但顯著高於乳腺癌和結直腸癌。在復發腫瘤中也發現了平均94%的初治腫瘤突變。
圖1.突變頻率
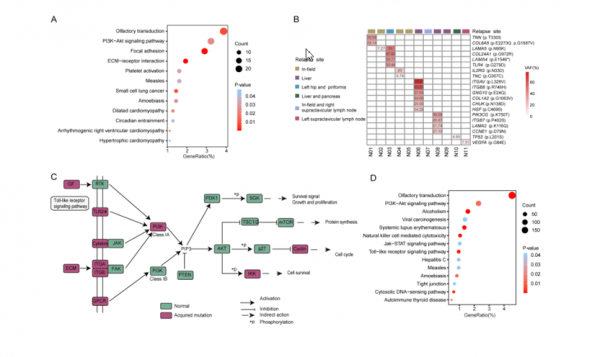
在11名患者(圖1A)的684個基因中總共鑑定出630個復發特異性(或獲得性)突變,復發樣本中獲得性突變的中位數為74個(範圍從1-32)。最高的復發特異性突變基因是RB1、PCLO、DNAH5、PRUNE2、SYNE1和TACC2。在這些基因中,據報道PCLO與ES-SCLC中的依託泊苷耐藥相關,而TACC2已被證明與神經母細胞瘤、腎細胞癌和前列腺癌的治療耐藥相關。這些獲得性突變涉及多種途徑,尤其是PI3K/AKT途徑。獲得性突變的基因在PI3K/AKT訊號通路中富集,11名患者中共有20個基因,其中16個基因位於該通路的上游。
放化療下SCLC的克隆進化
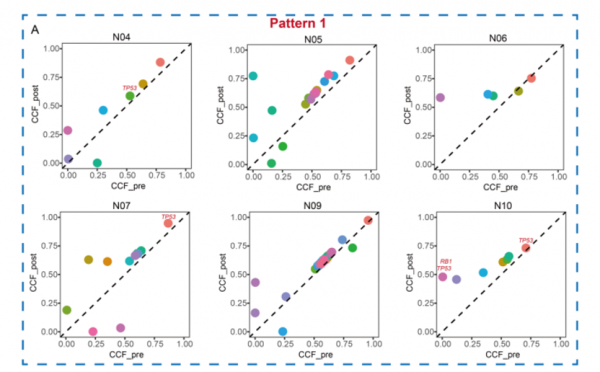
接下來透過PyClone推斷初治和復發SCLC腫瘤的亞克隆結構,以描述放化療下的克隆進化。大多數共享突變(95%)顯示覆發腫瘤的CCF(指的是腫瘤細胞中包含某個SNV的細胞所佔比例)增加,包括714個CCF增加。此外,迴圈樣本中的克隆數量也顯著高於未接受治療的樣本,表明CCRT後出現了新的克隆。
緊接著又比較了每位患者匹配的初治腫瘤與復發腫瘤之間的亞克隆結構。具有最大平均CCF突變的簇定義為主要克隆,否則定義為次要克隆或亞克隆。總體而言,初治腫瘤中的主要克隆在復發腫瘤中表現為主要或次要克隆(圖2)。
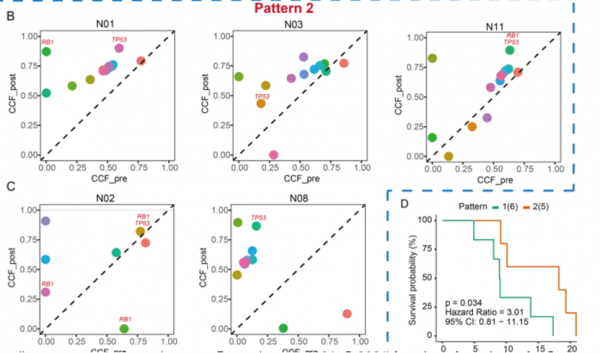
根據初治和復發腫瘤中克隆結構的變化,我們確定了兩種進化模式。第一種模式顯示在初治和復發腫瘤中均存在持續的主要克隆(患者N04、N05、N06、N07、N09和N10)。第二種模式的特點是初治腫瘤中主要克隆的減弱,然後繼續演變成兩種進化模式。具體而言,患者 N01、N03和N11顯示出未經治療的腫瘤中的一些次要克隆擴充套件為複發性腫瘤中的主要克隆(圖3)。另一方面,患者N02和N08顯示新克隆的出現和快速擴充套件,作為複發性腫瘤中的主要克隆。
在獨立的SCLC患者佇列和公共資料集中驗證PI3K/AKT通路的啟用
由於對與SCLC治療後復發相關的PI3K/AKT通路啟用特別感興趣,研究人員試圖在其他患者樣本以及公開可用的SCLC資料集中驗證這些發現。首先,對初始診斷時的cfDNA進行1,021個癌症相關基因的靶向測序,並對另外9名接受CCRT治療的LS-SCLC患者組成的獨立佇列進行了研究。
接下來,從接受標準鉑類化療的患者中獲得了第二組獨立的28個化療耐藥和23個化療敏感ES-SCLC樣本。基於無標記MS的蛋白質組學被應用於鑑定化療耐藥和化療敏感SCLC之間差異表達的蛋白質。MS分析揭示了85個差異表達的蛋白質,包括36個上調基因和49個下調基因在化療抵抗的小細胞肺癌。其中的多個基因與侵襲性癌症生物學和各種癌症的治療耐藥性相關。
此外,KEGG通路富集分析表明,差異上調蛋白的基因在WNT訊號通路、RNA降解、嘌呤代謝和HIF-1訊號通路中富集。PI3K/AKT通路在維持HIF-1α在各種惡性腫瘤中的轉錄、翻譯和生物活性方面起著關鍵作用。其中七個:KT1、AKT3、BCL2、IL6R、PIK3CA、PIK3CB和RPS6參與了HIF-1通路,其中6個位於HIF-1的上游。
小細胞肺癌治療耐藥相關的PI3K/AKT通路啟用功能的體外驗證
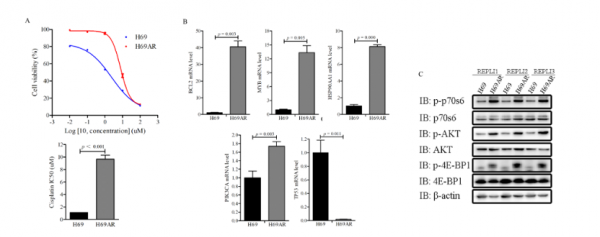
研究人員進一步嘗試使用一對化療敏感(H69)和化療抗性(H69AR)的SCLC細胞系驗證PI3K/AKT通路在SCLC治療耐藥發展中的作用。H69細胞系在幾個PI3K/AKT通路基因中含有突變,而H69AR與H69細胞相比顯示出順鉑耐藥。他們評估了攜帶獲得性CNV的14個基因的表達,複製數比(復發/初治腫瘤)>1.5複製數增加或<0.5複製數丟失。與CNV分析一致,具有複製數增加的MYB、PI3KCA、HSP90AA1和BCL2被上調,而具有複製數丟失的TP53在H69AR細胞中被下調。此外,還進行了蛋白質印跡以評估總蛋白以及PI3K/AKT途徑中關鍵基因的磷酸化形式。AKT及其下游靶標4EBP-1和p70S6的磷酸化在化療抗性H69AR細胞中增加。最後用順鉑處理有或沒有PI3K抑制劑(包括BEZ235、BKM120和GSK2126458)處理的H69AR、DMS53和H446細胞進行了細胞活力測定。
研究結果
基因組分析表明,在LS-SCLC復發時,PI3K/AKT訊號通路中的基因因獲得性體細胞突變或高頻獲得性CNV而富集。對來自ES-SCLC佇列的差異上調蛋白的通路分析揭示了HIF-1訊號通路的富集。最重要的是,含有獲得性體細胞複製數擴增的62個PI3K/AKT通路基因中有7個富含HIF-1通路。最後對來自公共資料庫的SCLC細胞系轉錄組資料的分析證實了化療抗性SCLC細胞系中PI3K/AKT和HIF-1通路的上調。
參考文獻:
Jin, Y., Chen, Y., Tang, H., Hubert, S. M., Li, Q., Hu, X., Su, D., Xu, H., Fan, Y., Yu, X., Chen, Q., Liu, J., Hong, W., Xu, Y., Deng, H., Zhu, D., Li, P., Gong, Y., Xia, X., Gay, C. M., … Chen, M. (2021). Activation of PI3K/AKT pathway is a potential mechanism of treatment resistance in small cell lung cancer. Clinical cancer research : an official journal of the American Association for Cancer Research, clincanres.1943.2021. Advance online publication. https://doi.org/10.1158/1078-0432.CCR-21-1943