作者:Daisy
導讀:近日,在《Nature Cell Biology》雜誌上發表了一項新的研究——利用幹細胞類器官模型揭示了一種新的幹細胞途徑,並且在COVID-19嚴重損傷的肺和特發性肺纖維化患者中可見。該研究為理解嚴重損傷的肺如何重塑提供了一個路線圖,並提供了一種潛在的途徑,透過靶向異常幹細胞分化來逆轉重塑。
COVID-19等疾病對肺部造成嚴重損傷,引發異常幹細胞修復,從而改變肺部結構。損傷後異常的幹細胞分化可阻止正常肺功能的恢復。
UCSF(加州大學舊金山分校)研究人員於近日在《Nature Cell Biology》雜誌上發表的一項合作研究中,UCSF研究人員Jaymin Kathiriya博士和Wang Chaoqun博士發現,嚴重的肺損傷可以觸發肺幹細胞發生異常分化。Drs. Kathiriya博士和Wang博士分別在醫學博士Hal Chapman和醫學博士Tien Peng的指導下,利用幹細胞類器官模型揭示了一種新的幹細胞途徑,在COVID-19嚴重損傷的肺和特發性肺纖維化患者中可見。
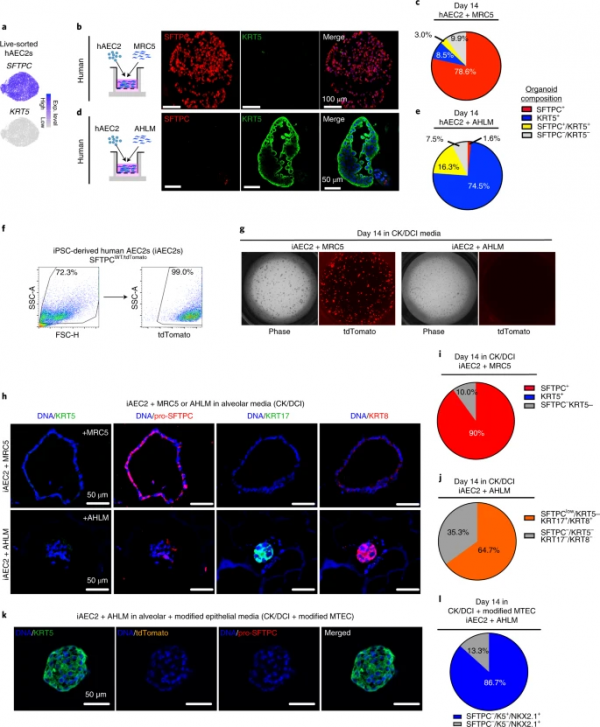
研究人員發表了一篇題為"Human alveolar type 2 epithelium transdifferentiates into metaplastic KRT5 basal cells+"的文章,先前在小鼠身上的研究表明,小鼠2型肺泡細胞(mAEC2)是肺泡中的常駐幹細胞群,它們構成了肺的整個氣體交換面。在特發性肺纖維化(IPF)中,瀰漫性實質性肺病是最致命和最普遍的形式,人類2型肺泡細胞(hAEC2s)從肺泡丟失,同時出現化生肺泡KRT5基底細胞,它們通常出現在導氣道。嚴格的遺傳譜系追蹤表明,小鼠肺泡中的化生KRT5細胞不是來自mAEC2s,而是來自因纖維化或病毒感染導致的嚴重肺泡損傷後小鼠氣道中的KRT5+−/SOX2祖細胞。然而,目前還不清楚在人類氣道中是否存在有助於化生基底細胞的類似群體,因為這兩個物種的呼吸道包含著關鍵的解剖學差異。這是一個臨床相關的問題,因為肺泡KRT5基底細胞與IPF患者的死亡率直接相關。在本研究中,研究人員驚奇地發現,在類器官培養和異種移植中,hAEC2s(而非mAEC2s)很容易轉分化為KRT5基底細胞。

https://www.nature.com/articles/s41556-021-00809-4
該研究為理解嚴重損傷的肺如何重塑和瘢痕提供了一個路線圖,並提供了一種潛在的途徑,透過靶向異常幹細胞分化來逆轉重塑。
之前已經認識到,肺泡駐留幹細胞(AEC2s)的再生能力,在小鼠和人類中運作類似。研究人員意外地發現,人類的AEC2s (hAEC2s)與小鼠的AEC2s不同,在病理成纖維細胞的情況下,能強勁地轉分化為功能性的基底細胞。體外hAEC2至基底細胞軌跡的單細胞分析顯示,在特發性肺纖維化患者的肺中存在移行細胞型別和基底細胞亞群。
利用一種新型的成纖維細胞/hAEC2類器官平臺,研究人員可以模擬嚴重肺泡損傷中出現的幹細胞化生或異常幹細胞分化。此外,hAEC2s可以產生病理移行細胞型別和基底細胞的發現,提供了在患病的人類肺中看到的幹細胞軌跡的實驗證實。
Peng博士說:“我們第一次看到hAEC2s分化為基底細胞,它是如此驚人,以至於我們認為這是一個錯誤。但是,對這一新軌跡的嚴格驗證,為肺部如何重塑以應對嚴重損傷提供了重大的見解,併為扭轉損傷提供了潛在的途徑。”
hACE2s可逐漸轉分化為化生基底細胞,這一發現並非IPF所獨有。肺泡化生基底細胞在硬皮病和新冠肺炎的肺切片中也很常見,在活躍的重塑區,這些細胞與移行細胞混雜在一起。在hAEC2衍生的類器官以及hAEC2異種移植和纖維化肺的組織學分析中普遍發現移行細胞,表明hAEC2s是嚴重肺泡損傷疾病中化生基底細胞的主要來源。
該研究為未來的研究奠定了基礎,以確定可能預防或逆轉嚴重肺損傷中化生分化的治療靶點,以及纖維化生態位的其他成分,如內皮細胞和免疫細胞是否能夠驅動化生表型。
參考資料:
https://medicalxpress.com/news/2021-12-uncovers-unique-stem-cell-trajectory.html
注:本文旨在介紹醫學研究進展,不能作為治療方案參考。如需獲得健康指導,請至正規醫院就診。
基礎研究
【Science子刊】改造人工肺——蜥蜴提供了驚人的方法!
腸道菌群
【Nature】降糖藥吃了無效?因為腸道菌群在作怪
癌症治療
【PNAS】中藥材百里香和牛至中發現了抗癌化合物
疾病診療
【Nature子刊】朝著改變700億美元的全球診斷行業又邁進了一步!蛋白質生物感測器可測量癌症、關節炎和器官移植患者中的有毒藥物
心血管疾病
【JAMA子刊】你有壓力嗎?壓力會增加心血管疾病風險!
科學研究
【Cell子刊】為什麼疼痛和焦慮會加快呼吸頻率?
科學研究
《Science》公佈2021年度突破:一個困擾生物學家50年的難題,被AI解決了,並實現了一位諾獎者的夢想!