sxr 生信人
咚咚咚,大家好,生信人2022年的第一個生信專題來敲門啦!他就是備受關注的癌症相關成纖維細胞(CAF)。且22年已經有相關文章出現(見下圖),影響因子還不低:雜誌Hepatology(IF:17+)。這篇文章講述了基於實驗發現CAF可以透過分泌IL6和IL33調控MDSCs(骨髓源性抑制細胞)來達到最佳微環境以提高腫瘤乾性。
不得不說有實驗支撐加上CAF熱點發文速度真是快。我們接下來的三天內會從不同的角度給大家多角度、全方位詳細介紹CAF。今天主要是講CAF背景感興趣的小夥伴不要錯過了。
癌症相關成纖維細胞
簡述
腫瘤組織中大量的腫瘤相關成纖維細胞(cancer associated fibroblasts, CAFs)為腫瘤的發展構建了良好的環境(佔基質細胞50%以上)。CAFs在癌症中扮演重要作用:CAFs不僅可透過分泌多種細胞因子或代謝產物抑制免疫細胞的功能,促進腫瘤發展、侵襲、轉移;CAFs 還具有塑造腫瘤外基質、形成藥物或治療性免疫細胞滲透屏障的阻止藥物與免疫細胞向腫瘤組織的深層滲透,從而降低腫瘤治療效果。因此,透過調控 CAFs 或克服其屏障作用抑制腫瘤是腫瘤治療的新手段。
(Ref:doi.org/10.1186/s12943-021-01463-y; IF:27)
CAFs的來源、異質性、免疫抑制作用
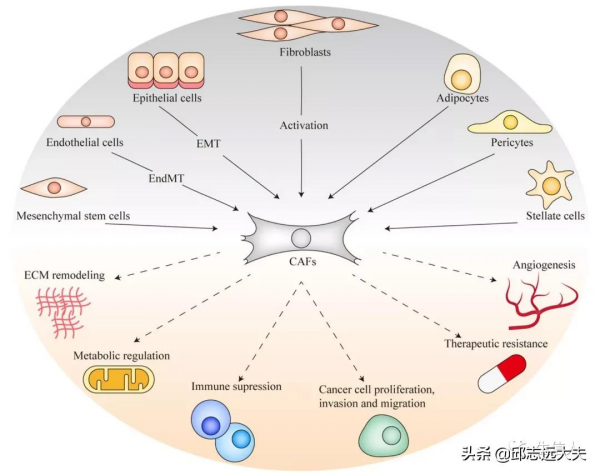
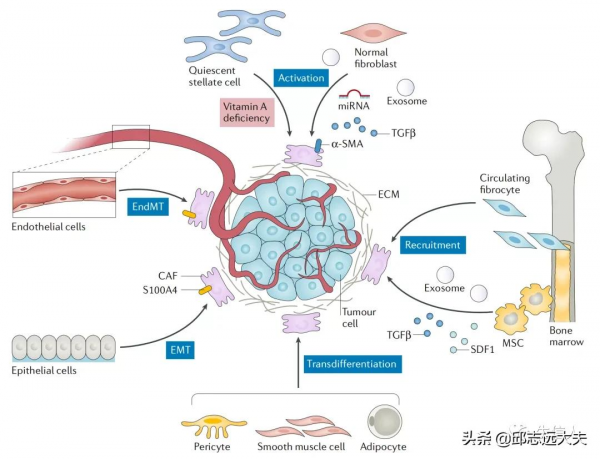
1、來源:主要是由組織中固有成纖維細胞或星狀細胞在生長因子,e.g.轉化生長因子-β(TGF-β)刺激作用下轉變為 CAFs;此外,腫瘤組織中的上皮細胞、內皮細胞、骨髓間充質幹細胞(MSC)等細胞也可分化為CAFs(Ref:PMID: 30470818; IF:84)。
2、腫瘤組織中CAFs異質性:不同亞型CAFs表面標誌物表達情況不同,如成纖維細胞活化蛋白(FAP)、α-平滑肌動蛋白(α-SMA)、成纖維細胞特異性蛋白1(FSP1)、血小板衍生生長因子受體(PDGFR)等。FAP被認為是 CAFs 特異性表達蛋白,因此FAP被廣泛用作靶向CAFs的靶標用於腫瘤治療或影像學診斷。α-SMA是活化成纖維細胞的標誌,通常作為靶向CAFs治療效果的一個主要評價指標。
(Ref:PMID:30470818; Nat Rev Drug Discov;IF:84)
3、CAFs免疫抑制機制:
CAFs 透過分泌各種細胞因子與其他基質細胞、腫瘤細胞進行資訊交流,抑制免疫細胞功能,促進腫瘤發展。CAFs可分泌一系列細胞因子: 如血管內皮生長因子(VEGF)可調控腫瘤血管網;TGF-β抑制DC成熟、促進Treg分化;白細胞介素6(IL-6)可促進MDSC分化,抑制細胞毒性T細胞;CXCL12使腫瘤細胞抗凋亡蛋白Bcl-2和Survivin上調從而產生耐藥性等;
CAFs可調控胞外基質,對藥物與免疫細胞的浸潤產生屏障作用。CAFs 透過分泌大量膠原、纖連蛋白等促進腫瘤外基質固化,抑制由腫瘤組織分泌趨化因子招募的免疫細胞、抗腫瘤藥物的滲透;
CAFs進行糖酵解排出大量乳酸與氫離子,形成酸性微環境,抑制免疫細胞活性。此外,CAFs能誘導上皮細胞發生上皮-間質轉化;CAFs 產生的大量細胞外基質還能增加微環境剛性和間質壓力,促進腫瘤的侵襲與遷移;CAFs 產生的乳酸和丙酮酸等代謝產物還能作為腫瘤細胞營養物質,支援腫瘤代謝。
(Ref:PMID:34635121; Mol Cancer;IF:27)
腫瘤CAF靶向策略
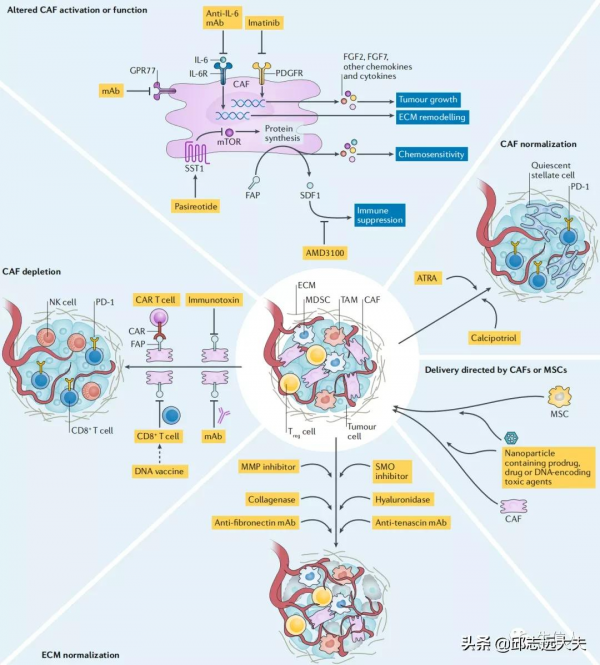
透過上述介紹我們已經知道CAFs 對腫瘤發展有著重要的促進作用。因此,靶向調控 CAFs的腫瘤治療策略有望抑制腫瘤進展。但傳統藥物遞送策略仍存在藥物分佈特異性不足、易產生系統毒性等問題從而限制這一腫瘤治療新策略的發展。奈米載體因其具備靶向遞送能力、藥物可控釋放和生物相容性好等特點,應用於靶向調控CAFs治療策略可增強藥物在靶部位的蓄積,提高耐受劑量並增強療效。目前靶向調控CAFs的腫瘤治療策略主要包括殺傷CAFs、干擾 CAFs 功能和干擾 CAFs 活化。
(Ref:PMID: 30470818; Nat Rev Drug Discov; IF:84)
21年裡CAF那些有意思的文章
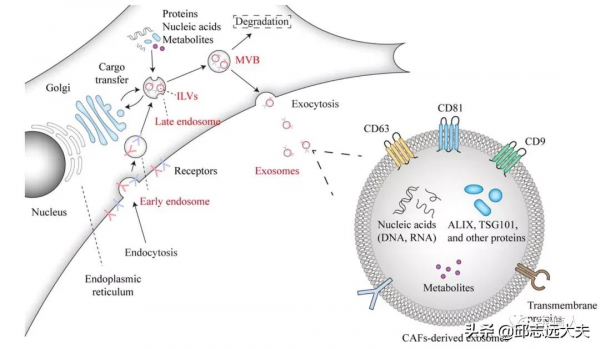
1、Cancer associated-fibroblast-derivedexosomes in cancer progression(Mol Cancer;IF: 27+;21年12月)
在這篇綜述專注於CAF衍生的外泌體在癌症進展中的作用。首先介紹CAFs 在癌症發展中的作用以及CAFs如何與TME中的其他細胞通訊。然後描述了CAF衍生的外泌體如何調節腫瘤細胞和TME的其他細胞。最後,由於外泌體在腫瘤生長相關的異質生物學過程並具有治療潛力,作者還討論了外泌體的臨床應用,特別是在免疫檢查點治療的增效作用。
TME中外泌體的示意圖
2、中山大學腫瘤防治中心和香港大學的關新元團隊在Science Advances(IF:14+)雜誌上發表文章《Laminin gamma 2–mediating T cell exclusion attenuates response to anti–PD-1 therapy》揭示了癌症相關成纖維細胞與腫瘤細胞相互作用,抑制T細胞浸潤,降低PD-1抗體藥物療效的新機制。
打破 Ln-2構建的屏障可激發強大的抗腫瘤免疫
3、
該研究依據癌症相關成纖維細胞 (CAF) 具有高度的異質性。缺乏對不同CAF之間功能區別的全面認識,目前仍無法基於患者腫瘤中的CAF制定個體化治療方案。研究建立了一個來自非小細胞肺癌 (NSCLC) 患者活檢的 CAF 生物庫,其中包含臨床 NSCLC中CAF 的廣泛分子譜。透過對接受相同治療的患者追溯 CAF功能上的異質性,確定了三種功能亞型。CAF功能分類與患者對靶向治療的臨床反應相關,也與腫瘤免疫微環境相關,為個體化治療提供了指導。以此為靈感,我們是否能基於CAF marker在癌症中做亞型的研究呢
。
建立活體生物樣本庫充分捕捉非小細胞肺癌CAF異質性
今天的CAF專題分享到這裡就結束了,大家讀完後是不是有收穫。如果沒有建議重新看一遍
。總之而言,腫瘤相關成纖維細胞不僅促進腫瘤的發生、增殖、浸潤、轉移和耐藥,同時參與血管生成、淋巴管生成、細胞外基質重塑、重構微環境等誘發癌症的事件,還對耐藥有十分重要的影響。說了那麼多,研究它SCI肯定沒跑了。