撰文 | 橙子
阿爾茨海默病(AD,Alzheimer's disease),俗稱早老性痴呆、老年痴呆、痴呆症,是一種發病程序緩慢、隨著時間不斷惡化的神經退化性疾病,此病症佔了痴呆症中六到七成的成因,目前並沒有可以阻止或逆轉病程的治療,只有少數方法或許可以暫時緩解或改善症狀【1】。
近期,來自康奈爾大學醫學院和舊金山格萊斯頓神經疾病研究所的Li Gan團隊在Science Translational Medicine雜誌發表題為AD-linked R47H-TREM2 mutation induces disease-enhancing microglial states via AKT hyperactivation的文章,使用單核精度的RNA測序對含有髓樣細胞觸發受體2 (TREM2,triggering receptor expressed on myeloid cells 2) 普通變體(CV,common variant)和R47H突變的AD患者腦組織進行測序,揭示了保守的人鼠TREM2 基因R47H突變的致病機制 ,支援了AKT訊號抑制劑作為小膠質細胞的調節策略來治療AD,為阿爾茨海默病的治療提供了重要理論基礎。
以往對於AD的全基因組關聯研究(GWAS,Genome-wide association study)分析確定了很多在小膠質細胞中高度表達的晚髮型散發型AD的風險等位基因,其中TREM2是迄今為止發現的最重要的免疫相關的風險因子,研究表明TREM2的R47H變體增加遲發性阿爾茲海默症風險。TERM2是一種單跨膜受體細胞表面分子家族,特異性在小神經膠質細胞中表達,控制炎症、骨穩態、神經發育和血液凝固。TERM2和它的適配體DNA聚合酶III亞單元12KDa tau啟用蛋白(DAP12,DNA polymerase III subunit tau activating protein of 12 kDa)一起招募脾相關酪氨酸激酶SYK(SYK ,spleen-associated tyrosine kinase),誘發一些訊號級聯反應,例如磷酸肌苷3-激酶(PI3K) -AKT和絲裂原啟用 MAPK通路[phosphoinositide 3-kinase (PI3K)–AKT,mitogen-activated protein kinase (MAPK) pathways],透過調控炎症細胞因子的分泌、增殖、吞噬和細胞存活來調控小神經膠質細胞功能。
目前,TREM2的R47H突變導致AD發生的機制還不清楚,有研究報道,攜帶雜合R47H變體的AD患者表現為較高的神經炎斑塊密度,更低的澱粉樣斑塊的小膠質細胞覆蓋率,更嚴重的斑塊相關神經炎營養不良,以及小膠質細胞中自噬體積累增加。組織轉錄組學研究表明,在R47H載體中,幾個免疫相關基因 [如干擾素調節因子8 (IRF8)和同種異體炎症因子1 (AIF1)]減少,但是目前並沒有在單細胞水平或患者腦組織大樣本量的轉錄組研究。R47H突變如何在小鼠中抵抗tau蛋白病,但在人類中卻提高AD風險仍然是一個令人費解的謎題。
這篇文章中,作者透過對46例含有CV或R47 H突變TREM2的AD患者的腦組織進行單核RNA測序 (snRNA-seq) 分析,發現了R47H富集的小膠質細胞亞群(圖1)。為了研究R47H在AD中引起的功能改變,作者接著使用基於CRISPR系統的遺傳工具將mTrem2的一個等位基因替換為CV-或R47H-hTREM2,產生一個雜合子R47H-hTREM2小鼠模型,然後將該模型與P301S tau蛋白病模型雜交。結果表明雌性雜合子R47H-hTREM2 tau蛋白病小鼠出現空間記憶缺陷加重的狀況。

圖1. R47H突變誘導細胞型別和性別特異性轉錄改變患者的大腦
此外單細胞轉錄本分析發現這些小鼠的膠質細胞出現R47 H轉錄本改變,和人類AD大腦的R47H膠質細胞很大部分重合,包括增加促炎細胞因子、AKT訊號的啟用以及DAM訊號子集的升高。用MK-2206藥物抑制AKT可逆轉TAU纖維處理所誘發的原發性小膠質細胞轉錄組變化和促炎細胞因子生成,且降低了R47H相關的小膠質細胞亞群並抑制tau蛋白病小鼠的突觸毒性(圖2)。
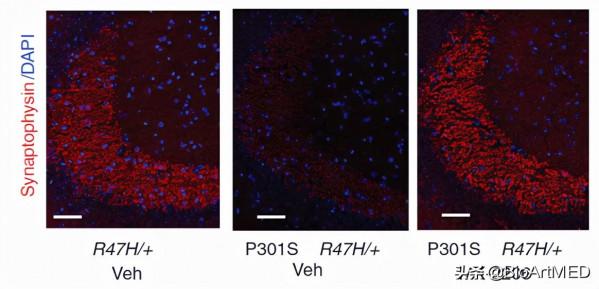
圖2.AKT抑制逆轉TAU纖維誘導的促炎症訊號, 逆轉R47H-hTREM2小鼠的tau病誘導的促炎性訊號和突觸丟失
總的來說,本研究揭示了阿爾茨海默病TREM2 R47H突變的疾病增強機制,同時提供了一個潛在的治療策略,為今後開發可調節大腦免疫反應並治療AD的藥物奠定了基礎。
原文連結:
DOI: 10.1126/scitranslmed.abe3947
製版人:十一
參考文獻
https://en.wikipedia.org/wiki/Alzheimer%27s_disease