1. 前言
Farnesoid X受體 (FXR)是核受體 (NR) 超家族的成員,被鑑定為膽汁酸 (BA)結合轉錄因子。FXR在肝臟、心臟、腎臟、腸和腎上腺皮質等各種器官和組織中廣泛表達。FXR可以被BAs啟用,BAs已被鑑定為內源性FXR配體。已經確定的FX基因有兩個,即FXRα和FXRβ。FXRα基因編碼四種具有生物活性的亞型(即α1、α2、α3和α4),並且FXRα的表達在從魚類到人類的物種間進化保守。FXRβ是人類和其他靈長類動物的假基因,但FXRβ具有功能性,可以在狗、齧齒動物和兔子中被羊毛甾醇啟用。
FXR作為一種腸肝調節劑,透過控制編碼調節BA代謝、脂質積累和葡萄糖穩態的酶的基因表達來調節全身能量穩態。
膽汁酸是由膽固醇前體合成的表面活性脂質,在營養吸收中起重要作用。與其作為穩態BA感測器的作用一致,高水平BA啟用FXR會啟動反饋迴路,導致膽固醇和BA合成減少。它透過誘導小異二聚體夥伴 (SHP) 的表達來實現,SHP是一種轉錄抑制因子,可抑制 BA 合成中的限速酶膽固醇 7α-羥化酶 (CYP7A1) 的表達。FXR還刺激成纖維細胞生長因子15/19 (FGF15/19)的表達,其透過不同的機制抑制CYP7A1的表達。FXR還直接啟用膽鹽輸出泵 (BSEP) 的表達,以增強糞便中BA和膽固醇的排洩。
FXR還透過抑制甾醇反應元件結合蛋白 (SREBP) 轉錄因子的活性來影響肝臟膽固醇和甘油三酯代謝。事實上,FXR介導的SREBP-1和-2抑制透過 SHP 途徑降低了參與膽固醇和脂肪酸從頭合成(FAS 和 ACC)以及脂蛋白分泌(APOC2和APOE)的幾個基因的表達並透過增加LDL受體的表達來增強脂蛋白殘餘物的再攝取。最後,已經表明FXR可以直接增強PEPCK1的表達,PEPCK1 是肝細胞中糖異生的限速酶,但它對葡萄糖穩態的影響似乎尚不清楚。
作為NR超家族的成員,FXR蛋白具有共同的模組結構,由N端啟用功能域 (AF-1)、保守的DNA結合域 (DBD)、配體結合域 (LBD) 組成。)具有C端域 (AF-2)和靈活的鉸鏈區(圖1)。
圖1. FXR受體的結構(圖片來源:J. Med. Chem.)。
FXR是多種代謝NR 之一,如肝X受體 (LXR)、過氧化物酶體增殖物啟用受體 (PPAR)、孕烷X受體/類固醇和異生素受體 (PXR/SXR)、雄甾烷受體 (CAR)、維生素D受體 ( VDR) 和肝受體同源物-1 (LRH-1)。這些受體是由脂溶性訊號啟用的轉錄因子,例如膽汁酸 (FXR)、氧甾醇 (LXR)、花生四烯酸代謝物 (PPAR) 以及地塞米松和孕烯醇酮 (PXR)。
Bahaa Elgendy等最近刊文J. Med. Chem., 討論了靶向FXR的各種化合物用於代謝疾病治療的研究進展。該文側重於FXR調節劑,包括激動劑、拮抗劑和雙重調節劑。
2. FXR配體的治療應用
由於FXR作為BA穩態、脂質穩態、葡萄糖穩態和氨基酸代謝的腸肝調節劑發揮著重要作用,FXR 配體的鑑定有望用於治療與代謝異常相關的各種疾病,如糖尿病、肥胖症、肝臟疾病、腸道慢性炎症、膽汁淤積和腎臟疾病。
使用FXR激動劑治療多種肝臟疾病引起了極大的興趣。非酒精性脂肪性肝病 (NAFLD) 是在沒有過度飲酒或其他可歸因原因的情況下,脂肪在肝臟中異位積累,包括以炎症和纖維化為特徵的疾病的更晚期形式(非酒精性脂肪性肝炎 (NASH))。NAFLD可能影響全球20-40% 的人口,並可進展為晚期纖維化、肝硬化和肝細胞癌。FXR 激動劑透過糾正中間代謝和脂質積累的異常、抑制代謝應激誘導的p53啟用、抑制纖維化的進展和減少炎症,具有治療肝臟疾病的治療潛力。FXR調節BA體內平衡,這對於消除膽固醇和激素調節在生理上很重要。因此,FXR激動劑和拮抗劑在治療原發性膽汁性膽管炎 (PBC)和原發性硬化性膽管炎 (PSC) 方面都具有治療價值。
腎臟參與BAs的分泌和重吸收。因此,FXR調節劑可以透過直接或間接的抗炎、抗脂肪生成、抗氧化和抗纖維化作用為腎臟疾病帶來益處。
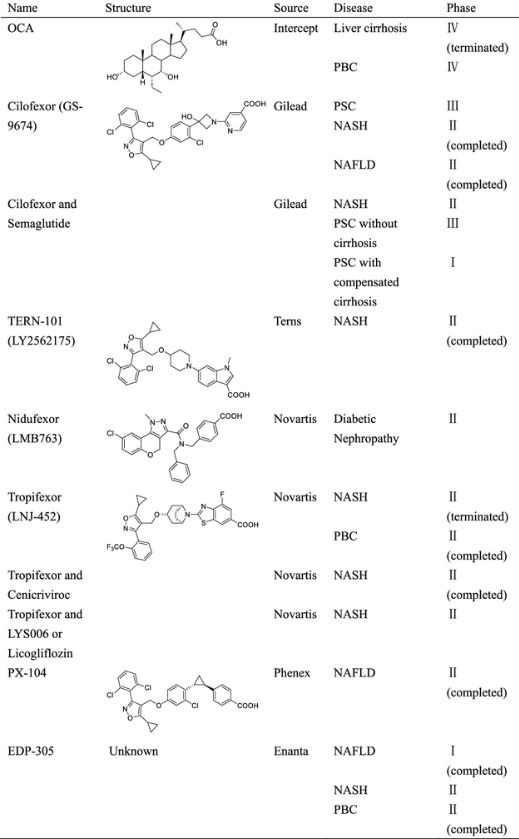
幾家製藥公司和學術實驗室已經開發了大量的FXR配體,並繼續使 FXR 配體的化學武器庫多樣化。包括奧貝膽酸 (OCA)、cilofexor (GS-9674)、TERN-101 (LY2562175)、nidufexor (LMB763)、tropifexor (LNJ-452) 和 EDP-305 在內的幾種化合物目前正在臨床試驗中用於治療 NASH、PBC、PSC和肝纖維化(表1)。不幸的是,由於不良副作用,包括對高密度和低密度脂蛋白濃度的血脂異常影響、瘙癢和肝硬化PBC患者肝臟失代償風險增加,許多化合物已在臨床前或臨床試驗中停止。FXR激動劑透過調節反向膽固醇轉運降低HDL濃度,並且至少在臨床前模型中不會加劇動脈粥樣硬化。然而,瘙癢和肝臟失代償的機制尚不清楚,並構成推進FXR激動劑的重大障礙。這些嚴重且劑量限制性的副作用推遲了 FXR激動劑作為治療藥物的批准和廣泛使用,並且可能是由於FXR的直接啟用而不是脫靶效應。因此,設計有效但不會引起不良反應的FXR激動劑對藥物化學家來說仍然具有挑戰性。
表1. 臨床試驗中的FXR配體(圖片來源:J. Med. Chem.)。
3. FXR配體的藥物化學
3.1. FXR LBD結構
已經報道了多種形式的FXR的幾種X射線晶體結構,例如單體、同二聚體或異二聚體。與激動劑、部分激動劑和拮抗劑複合的FXR蛋白的LBD已在主要文獻中報道。FXR的特點是靈活的配體結合口袋,根據結合配體的型別採用不同的構象狀態。發現大多數報道的配體佔據FXR LBD的疏水口袋,主要與位於H3、H5、H7、H11和H12上的殘基相互作用。在FXR活性構象中,helix12 (H12) 採用適合共啟用因子結合的構象。共啟用劑透過兩個保守的離子相互作用與FXR LBD 結合,與 K303 (H3)和E467 (H12)形成電荷鉗。apo-FXR構象(PDB 5Q0K 和 6HL0)與共啟用肽複合,並具有與活性激動劑結合受體相似的整體構象(圖2A)。然而,核磁共振研究表明FXR在溶液中以不同的構象存在。在與天然激動劑CDCA(PDB 6HL1和4QE6)結合的FXR結構中,配體與Arg331、His447 和 Tyr361 具有氫鍵相互作用。連線H4/5和H6的環區(殘基 K339-P341)不穩定,表明配體結合誘導了該環區的額外靈活性(圖2B)。在合成配體 GW4064 的情況下,該配體還與Arg331具有氫鍵相互作用。GW4064異惡唑基團佔據 H11 和 H12 之間的疏水區域,處於非常有利的位置,使 His447-Trp469 啟用開關保持 π-π 堆積相互作用,從而使 H12 穩定在活性構象中(圖2C)。與 FXR/CDCA 結構不同,連線 H4/和H6(殘基 K339-P341)的環區在合成激動劑GW4064存在下穩定。在與基於萜類化合物的激動劑 tschimgine (PDB 5IAW) 和亞鐵啉 (PDB 5ICK) 結合的 FXR 的晶體結構中報告了另一個疏水性結合口袋(圖 2H)。Tschimgine 像其他配體一樣佔據結合位點,而亞鐵靈誘導H6向外移動和 H2 變形,產生第二個口袋以容納垂直於第一個配體的額外體積,導致配體的大量擴充套件口袋大小(圖2D)。Merk等人最近報道了透過晶體學和核磁共振實驗確定的驅動部分 FXR 啟用的分子機制。在與部分激動劑DM175 (PDB 4QE8) 複合的 FXR LBD 的共晶結構中(圖2F),觀察到H11中的扭結導致 H11-H12 環不穩定,這是螺旋α12取向的關鍵結構決定因素(圖2E)。與天然和合成的FXR激動劑不同,H11-H12 環區域在結合時穩定,合成的部分激動劑誘導構象狀態,能夠同時招募輔助抑制因子和輔助啟用因子,從而導致輔助啟用因子和輔助抑制因子結合的平衡。另一方面,拮抗劑配體(伊維菌素)結合(PDB 4WVD)誘導無活性狀態,H11-H12 環構象狀態紊亂,完全缺乏 H12(圖2F),共阻遏肽與 FXR 結合。FXR配體佔據FXR配體結合位點內的不同區域,如與激動劑GW4064、部分激動劑 DM175 和拮抗劑伊維菌素結合的FXR-LBD結構的疊加所揭示的(圖2G)。 FXR激動劑GW4064的結合由包含 H3、H4/5和H11的LB區域定義,而部分激動劑 DM175 的特徵在於結合位姿向 H11-H12 環突出。伊維菌素結合向H2-H3環區域(Ω環)突出,導致 FXR-LBD 的構象靈活性和H12的不穩定。
圖2.與不同配體結合時 FXR 構象的整體結構。(A) Apo-FXR 結構(PDB:6HL0);(B) FXR/CDCA (6HL1);(C) FXR/GW4064 (3DCT);(D) FXR/feroline (5ICK);(E) FXR/DM175 (4QE8); (F) FXR/伊維菌素 (4WVD)。 (G) FXR 結構4QE8中不同配體結構的疊加。FXR 以灰色條帶顯示,配體和重要的氨基酸殘基以棒狀表示。(H)基於萜類化合物的激動劑 tschimgine 和亞鐵靈以及部分激動劑DM175(圖片來源:J. Med. Chem.)。
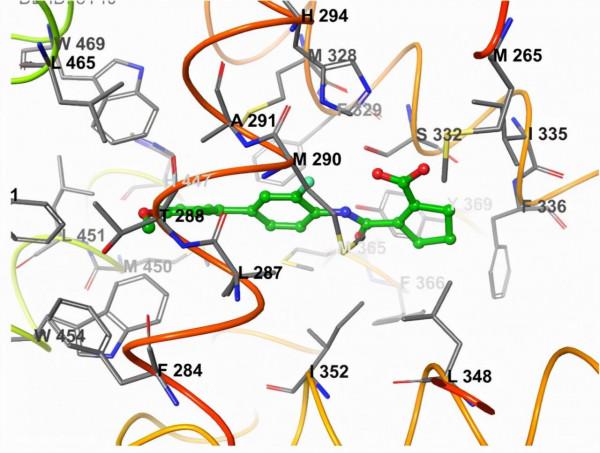
值得一提的是,與tropifexor複合的FXR-LBD 的新X射線結構於2021年由Chen等人發表。目的是確定tropifexor活性和對FXR的選擇性的結構基礎。 FXR/tropifexor複合物 (PDB:7D42) 與FXR/GW4064複合物 (PDB:3DCT) 的疊加表明這兩種複合物非常相似,並且兩種配體在配體結合袋中佔據相似的區域(圖3A)。 tropifexor的苯並噻唑環佔據疏水口袋的狹窄部分,並與Met265和 Arg331 形成氫鍵(圖3B)。異惡唑氮參與與 Leu287、Tyr288 和 His447的疏水相互作用。 2-三氟甲氧基苯環與Phe329、Met365和Ile357形成疏水接觸,環丙基與 Met290、Ala291和Met328的側鏈形成疏水接觸,並與His294形成氫鍵相互作用。
圖3. (A) FXR/tropifexor(青色)和 FXR/GW4064(灰色)的疊加。 (B) FXR (PDB:7D42) 的LBP中tropifexor的分子相互作用(圖片來源:J. Med. Chem.)。
作者試圖使用分子模型解釋tropifexor對FXR的選擇性超過TGR5。他們得出結論,tropifexor誘導與部分TGR5正構位點的空間衝突(即tropifexor 的-OCF3基團和TGR5的F96)。雖然該資料提供了一些關於缺乏TGR5 tropifexor活性的見解,但它沒有得到實驗證據的支援。
3.2. FXR激動劑
3.2.1.非甾體FXR激動劑
3.2.1.1.基於異惡唑的 FXR 激動劑
儘管GW4064於1998年被發現,但它仍然是FXR配體的主要模板,其中大多數已鑑定的配體保留了GW4064的結構特徵。特別是,異惡唑核心及其取代基(即3位的2,6-二氯苯基和5位的異丙基)在大多數報道的合成FXR激動劑中均保留在主要文獻和專利中。出於這個原因,GW4064 的這部分通常被描述為“錘頭”結構。對FXR和不同異惡唑激動劑的大量共晶結構的分析顯示了一種共同的結合模式,其中異噁唑環結合在一個非常有利的位置,能夠開啟His447-Trp469啟用開關並導致轉錄啟用。
取代異噁唑環的SAR研究表明,只有三唑和吡唑是可行的替代品。異噁唑環上的取代基支援異惡唑環在LBD內的優先定位,以啟動與His-Trp開關的有利相互作用。異丙基和 2,6-二氯苯基的大多數修飾導致激動活性完全喪失。儘管該領域的智慧財產權空間具有挑戰性,但藥物發現工作繼續集中在基於異噁唑的 FXR激動劑上,以改善這些配體的藥代動力學和體內功效。
Zampella等人報道了一系列含有異噁唑的FXR激動劑,用於預防對乙醯氨基酚引起的肝損傷(圖4)。他們以GW4064作為先導化合物開始,並確定了一種具有納摩爾效力的新型化合物 1(EC50 = 300 nM,Emax = 149% 對比CDCA)。
圖4. FXR激動劑GW4064、1 和 2(圖片來源:J. Med. Chem.)。
1的分子模型表明它表現出類似於GW4064的分子相互作用。1的羧基與 Met265 形成氫鍵,與Arg331形成鹽橋(圖5)。該末端羧基(在m位或p位)對於活性至關重要,對極性較小的基團的修飾削弱了與Arg331的相互作用並導致活性顯著降低。類似地,較短的苯氧乙基接頭削弱了相同的相互作用,並且由於較短接頭周圍的氨基酸殘基(例如 Ile335、Met265 和 Met290)的疏水性,只有不帶電荷的官能團表現出更好的功效。
圖5. FXR LBD晶體結構中 1(青色)的對接姿勢。
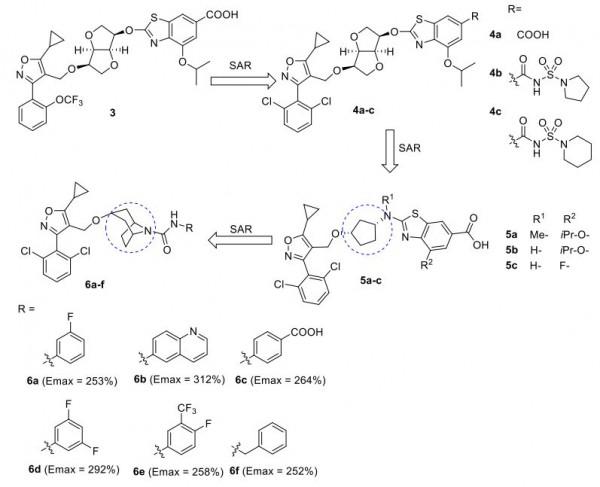
最近,Enanta Inc.的一個小組披露了2500多種化合物作為FXR激動劑。所有這些化合物在結構上都與tropifexor相關,但除了託烷之外,還包含各種雙環片段作為中心接頭。在開發的系列之一,化合物 3-6(圖6)是最有效的衍生物,對hFXR表現出很強的激動活性(EC50 < 30 nM)和良好的療效(Emax (%) = 103 (3), 93.1 (4a)、103 (4b) 和 96.5 (4c)),與作為對照的CDCA相比,其有效性設定為100%。化合物3和4a-c具有六氫呋喃作為中心連線體,羧基或N-取代的氨磺醯基苯甲醯胺基團作為末端取代基。
圖6. 來自Entana專利申請的FXR激動劑3-6(圖片來源:J. Med. Chem.)。
化合物7-11(圖7)是基於tropifexor作為先導物進行設計的。與PX-104類似,帶有二甲基哌啶的化合物7上調了HepG2 細胞中的BSEP基因表達。用雙環取代二甲基哌啶環產生8-11,在BSEP表達增加的情況下孵育 0分鐘後,其在肝微粒體中表現出良好的代謝穩定性。
圖7. FXR 激動劑7-11(圖片來源:J. Med. Chem.)。
另一個系列,12a-f,帶有二氫異惡唑,被開發為強FXR激動劑(圖8)。所有化合物在人類ether-a-go-go相關基因 (hERG) 測試中均顯示出良好的安全性(IC50 > 30 μM)。用哌啶環和用噻唑取代的託烷環取代12中的中央苯環分別產生更有效的FXR激動劑13和14。化合物13是一種強激動劑 (EC50 = 12 nM),具有高效(Emax = 101% vs CDCA)。13種大鼠的PK研究表明13種表現出良好的PK特性。化合物14在肝微粒體中穩定,在2個物種中的半衰期值超過150 分鐘。
與14類似,FXR激動劑15和16a,b已被報道並顯示出高效力和功效。
圖8. FXR激動劑12-17(圖片來源:J. Med. Chem.)。
FXR激動劑18a、b 是基於tropifexor設計的,並具有連線到託烷環的磺醯胺接頭。與作為陽性對照的PX-104 相比,兩種化合物都表現出良好的FXR激動活性(圖9)。引入惡二唑環作為磺醯胺接頭的生物等排體得到了有效的激動劑19a-h (EC50 < 50 nM)。
圖9. FXR激動劑18a、b和19a-h(圖片來源:J. Med. Chem.)。
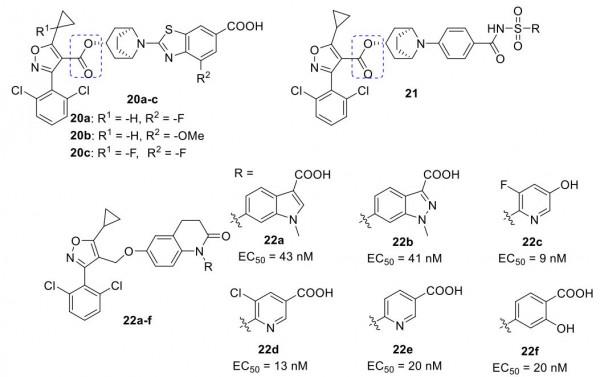
Ardelyx, Inc. 的一個小組基於tropifexor開發了一系列FXR激動劑20a-c和21(圖10),這些激動劑在先導化合物中具有酯接頭而不是醚接頭。
圖10. FXR激動劑20-22(圖片來源:J. Med. Chem.)。
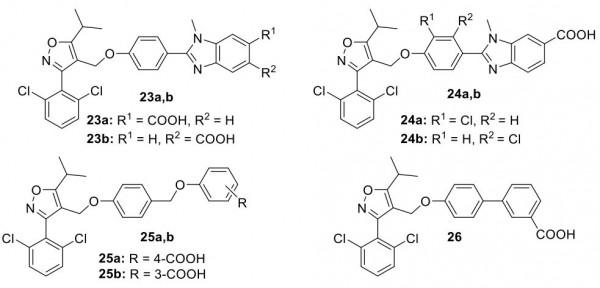
Teno小組描述了一系列帶有苯並咪唑環(即23a,b和24a,b)的新系列FXR 激動劑。這些化合物的效力是GW4064 的兩倍(EC50 (nM) = 43.7 (23a)、64.4 (23b)、13.4 (24a)、31.6 (24b),Emax範圍從51.1%到76.4%與GW4064相比)並且顯示出較低的毒性。化合物24a、b增強了鹼性磷酸酶 (ALP) 在 ST-2 MSC 的成骨細胞分化中的表達。此外,24a在骨形態發生蛋白2 (BMP-2) 誘導ST-2間充質幹細胞分化期間上調矮小相關轉錄因子2 (RUNX2) 的表達,這使24a成為治療骨病的重要藥物。 BAR Pharma公開了具有苯甲酸部分的化合物25a、b 和 26。這些化合物表現出比CDCA強得多的功效和良好的效力(例如,25b EC50 = 1.4 μM,Emax = 175% vs CDCA)。此外,與 GW4064 相比,25a和26誘導的SHP 表達超過6倍(圖11)。
圖11. FXR激動劑 23-26(圖片來源:J. Med. Chem.)。
Xu等人報道了FXR激動劑 27a-c(圖12)具有環丙烷作為接頭。與作為陽性對照的GW4064相比,它表現出強大的FXR激動活性(EC50 < 100 nM),但沒有更多關於該系列的資料。另一系列包含氟哌啶(即28a-d 和 29)和氟託烷 (30) 的高效 FXR 激動劑也被設計並被合成了。化合物 28-30 顯著改善了FXR 激動作用,並顯示出單位數納摩爾範圍內的EC50值。
最近,報道了含有哌啶部分的密切相關的FXR 激動劑(圖12)。在該系列中,哌啶氮結合在尿素接頭中,該接頭與苯甲酸部分相連。在該系列中,31a、b 是最有效的激動劑,與GW4064相比顯示出強大的功效(31a和31b分別為86% 和78%)。
圖12. FXR 激動劑27-31(圖片來源:J. Med. Chem.)。
Haiborui Pharma的一個小組開發了一系列具有比GW4064更高效力的螺環 FXR 激動劑32a-d(圖13)。Sunshine Lake Pharma Co., Ltd. 公開了另一系列具有三環支架的強效FXR激動劑33a-d,並以 OCA 作為陽性對照顯示了個位數的納摩爾效力。
圖13. FXR 激動劑32a-d和33a-d(圖片來源:J. Med. Chem.)。
3.2.1.2.非異噁唑類FXR激動劑
儘管由於異噁唑基團的極端重要性而難以開發基於非異惡唑的新型FXR 激動劑,但幾個研究小組成功地發現了此類激動劑。
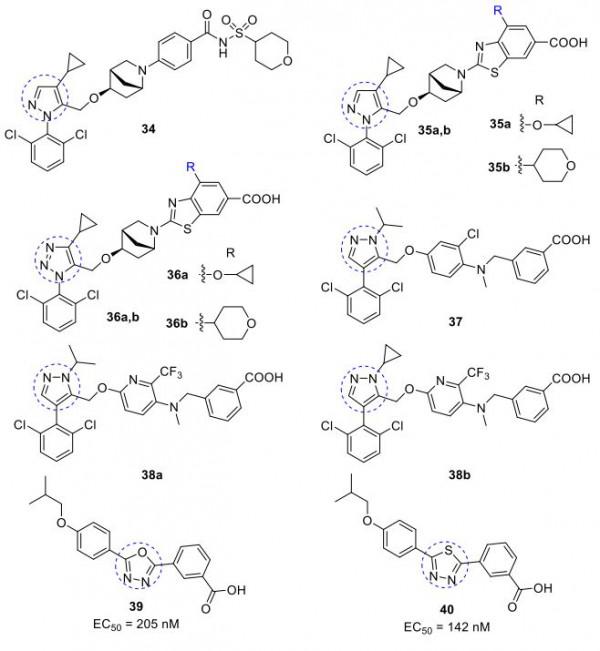
Ardelyx, Inc.的一個小組透過用吡唑和三唑環取代異惡唑環開發了非異惡唑 FXR激動劑 34-36。這些激動劑顯示出在個位數納摩爾範圍內的效力,並且比 GW4064更有效(Emax 範圍為116%~147%)。另一系列吡唑激動劑37和38a,b(圖14)發表在專利中,它們表現出比GW4064更好的生物活性。
圖14. FXR激動劑34-40(圖片來源:J. Med. Chem.)。
利用高通量篩選發現了新型化學結構的FXR激動劑的二氫色基吡唑41(圖15)。該化合物的EC50為480 nM,與GW4064相比顯示出70%的功效。在三環核心上引入了取代基,並對苄基環進行了修飾,試圖提高這種新化學型的功效和代謝穩定性。不幸的是,所有化合物(結構未顯示)都表現出較差的穩定性和較差的水溶性。在分子模型的指導下,引入了苯甲酸部分,並研究了核心和苯甲酸之間的各種接頭,從而鑑定出42-44為部分激動劑(Emax = 79% (42), 83% (43)和 57% (44) vs GW4064)具有有吸引力的PK性質。
圖15. 41-44的FXR激動劑(圖片來源:J. Med. Chem.)。
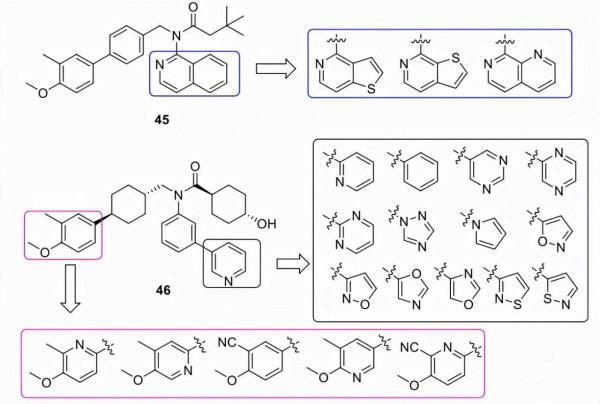
Metacrine, Inc.的一個小組在專利中報道了一系列雙環雜環衍生物(例如45)和反式環己基醯胺(例如46)(圖16)。這些 FXR 激動劑中的大多數顯示出良好的活性(EC50 < 1 μM ) 與作為陽性對照的fexaramine相比,但沒有報告更多資料。
圖16. FXR激動劑45和46(圖片來源:J. Med. Chem.)。
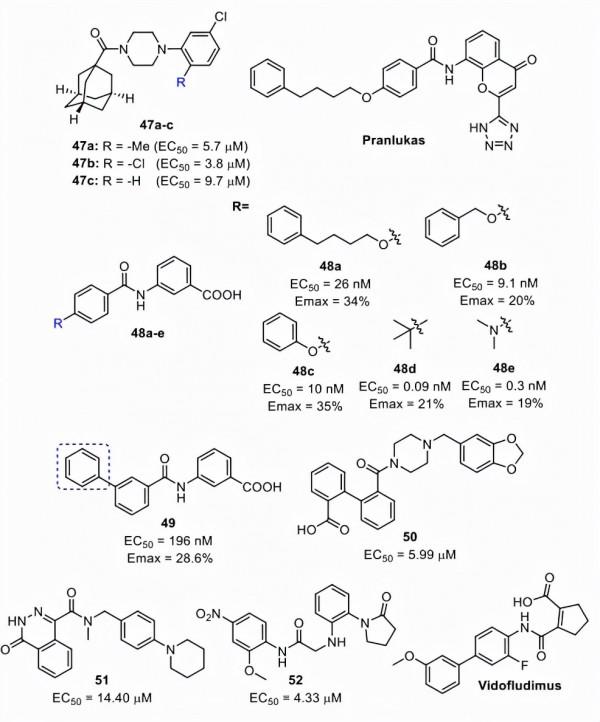
化合物47a-c(圖17)從虛擬篩選中鑑定為中等FXR激動劑,其活性在微摩爾範圍內。
Pranlukast 是一種半胱氨醯白三烯受體-1 拮抗劑,作為部分FXR激動劑的活性較弱(EC50 = 15 μM,Emax = 27%與GW4064),並被Merk和同事用作先導化合物來鑑定新型FXR激動劑。普侖司特的最佳化開始於用苯甲酸代替2-四唑-色烯酮。這種修改是成功的,併產生了新的激動劑,例如48a,它顯示出最強的效力(EC50 = 26 nM,Emax = 34% 與 GW4064)並改善了代謝穩定性。最佳化的第二階段側重於透過改變0到4個碳原子的鏈長來修飾親脂性醚接頭。結果表明,具有最短鏈長的化合物48b(n=1)和48c(n=0)具有顯著的FXR活性。與48a相比,化合物48c具有更好的水溶性,而48b在溶解性或毒性方面沒有表現出改善。最後,使用叔丁基和二甲胺基代替48c中的苯氧基,從而鑑定出皮摩爾部分激動劑 48d 和 48e(圖 18)。化合物48e誘導FGF-19和BSEP的表達並部分誘導SHP和CYP7A1的表達。此外,48e表現出良好的水溶性和無細胞毒性。
Li等人基於48c作為先導化合物,開發了另一種有效的FXR部分激動劑(即 49)。
化合物 50-52是三種新的化學型,它們是使用基於先導結構的藥效團方法鑑定的。
圖17. FXR 激動劑47-52(48a-e和49的Emax是針對作為對照的GW4064測量的)(圖片來源:J. Med. Chem.)。
Vidofludimus(圖17)是二氫乳清酸脫氫酶 (DHODH) 的抑制劑,目前正在進行PSC的臨床試驗 (NCT03722576)。這種藥物是口服生物可利用的,在Li等人的藥物重新定位努力中被鑑定為有效的FXR激動劑 (EC50 = 450 nM)。vidofludimus 在FXR (PDB:5Y1J) 的 LBD中的共晶結構揭示了其結合的分子基礎和觀察到的活性(圖19)。
圖19. vidoffludimus在FXR (PDB:5Y1J) 的LBD中的晶體結合姿勢(圖片來源:J. Med. Chem.)。
3.2.2.甾體FXR激動劑
在甾體FXR激動劑領域,開發FXR特異性和組織選擇性配體的需求尚未得到滿足。預計此類配體的開發將減輕通常與使用FXR配體相關的副作用,因為其具有多效性。
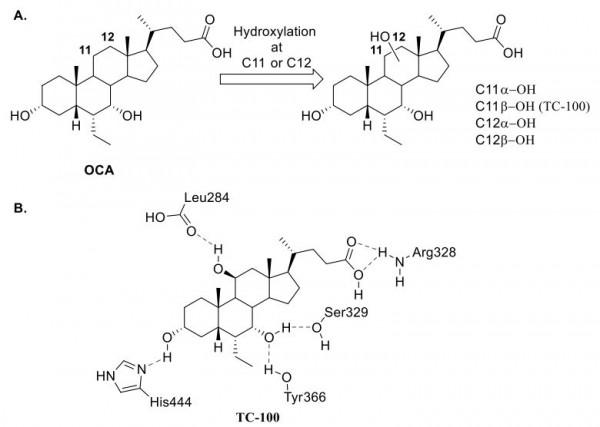
在過去的幾年中,該領域取得了進展,Pellicciari等人能夠使用基於結構的設計來開發TC-100作為第一個選擇性FXR激動劑。透過檢查與CDCA (PDB 4QE6)複合的FXR 的人類LBD的高解析度晶體結構,作者確定了一個由三個殘基Leu287、Ala291和Met328 定義的小口袋,排列在CDCA的C11-C12 位置並含有一個水分子。這種水分子的存在表明空腔具有極性特徵,並揭示了透過 BA 類似物的 C11 或 C12 或兩者的羥基化來增強效力和選擇性的可能性。因此,合成了OCA羥基化衍生物 C11α、C11β、C12α 和 C12β 以利用該口袋(圖20A)。這些衍生物的初始對接表明它們保持了OCA觀察到的保守氫鍵和疏水接觸。有趣的是,發現羥基衍生物C11β (TC-100) 和C12β與Leu284的羰基形成額外的氫鍵。
圖20. (A)針對FXR LBD中的小極袋的策略。 (B)從TC-100的MD模擬中確定的氫鍵(圖片來源:J. Med. Chem.)。
BrightGene的研究人員公佈了三種OCA牛磺酸鹽衍生物53-55的資料(圖 21),它們比OCA更有效。在PBC大鼠模型中,所有三種化合物都降低了血清中的ALP和TBil水平並改善了肝纖維化。此外,在大鼠NASH模型中,53-55 顯著降低血清中的ALT和AST。
圖21. 甾體FXR激動劑53-59(圖片來源:J. Med. Chem.)。
Enanta Pharma的研究人員根據OCA的結構公開了一類磺醯氨基甲酸酯衍生物(60,圖22)作為FXR激動劑。所有化合物都顯示出很強的激動活性 (EC50 < 1 nM)。沒有披露關於這些化合物的更多資料。受這些化合物的啟發,NZP的研究人員公開了新型磺醯脲和磺醯胺衍生物61-64作為有效的FXR激動劑,具有兩位數的納摩爾活性和強大的功效(Emax = 193% (61)、151% (62)、219% (63) ),以及148% (64) 與GW4064)。化合物63增加SHP和OST-α表達水平,同時以劑量依賴性方式抑制CYP7A1和TGFB1表達水平
圖22. FXR激動劑 60-64(圖片來源:J. Med. Chem.)。
3.3. FXR拮抗劑
開發用於治療高脂血症、膽汁淤積、肥胖和相關代謝紊亂的 FXR 拮抗劑越來越受到關注。最近,特諾等人。基於命中化合物65開發了非酸性 FXR 拮抗劑(圖23)。修飾的第一步是透過引入哌啶取代環己基環進行,產生兩種有效的拮抗劑66a和66b,具有低納摩爾 IC50 值且未觀察到毒性。化合物66a以劑量依賴性方式抑制由CDCA和GW4064誘導的BSEP、SHP和OSTα的表達。化合物 66a 透過降低 3T3-L1 細胞中的細胞內 TG 水平來減少脂質積累。在特異性面板中對 66a 的評估表明,66a 對密切相關的 NR 沒有活性,例如 PPARα、γ、δ、LXRα、β 和 RXRα。 66a 的分子模型表明66a與FXR的LBD中的65 類似地結合。預計 N-醯基哌啶部分會與His298形成氫鍵。
圖23. FXR 拮抗劑65和66a-e(圖片來源:J. Med. Chem.)。
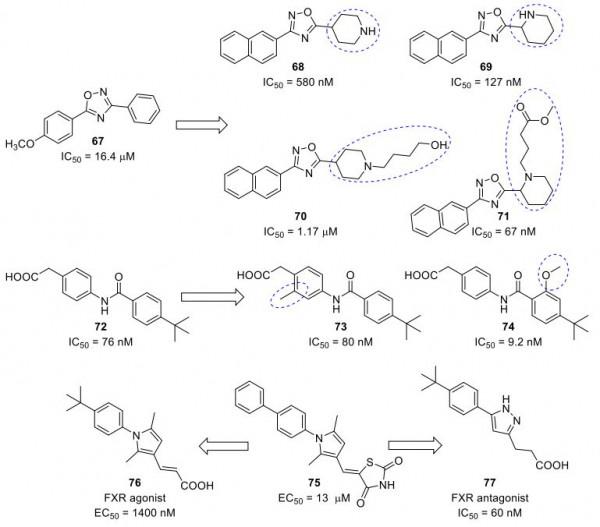
GW4064的簡化和用3,5-二取代噁二唑替換異惡唑環導致鑑定出67(圖24),其對FXR顯示出弱拮抗作用,並被用作開發基於這種多功能的有效類似物的起始骨架結構。
圖24. FXR拮抗劑67-77(圖片來源:J. Med. Chem.)。
甘氨酸-β-鼠膽酸 (Gly-MCA, 78b) 是一種甾體拮抗劑,被鑑定為腸道中 FXR 訊號傳導的有效抑制劑,但在肝臟中則不然。該化合物是基於密切相關的拮抗劑 T-β-MCA (78a) 在計算機上設計的(圖25)。
圖25. 甾體拮抗劑T-β-MCA和Gly-MCA(圖片來源:J. Med. Chem.)。
3.4.雙調節劑
許多疾病本質上是多因素的,它們的治療可能受益於用一種藥物靶向多種協同途徑。已知肝臟疾病是多因素的,並且會受益於啟用FXR和調節其他感興趣的目標的累加效應。
為此,Merk等人繼續開發苯甲醯胺類似物作為雙重FXR/可溶性環氧化物水解酶 (sEH) 調節劑。他們開發了化合物79(圖26),它具有有效的FXR激動活性(EC50 = 20 nM,Emax = 35% vs OCA)和強大的sEH抑制活性(IC50 = 4.1 nM),作為使用雙重調節劑的概念證明用於治療多因素肝病。
Merk 等人公開了另一類二苯甲醯胺衍生81a,b和82a,b。作為雙重 FXR/PPARδ 激動劑(圖26)
這些有希望的結果鼓勵 Merk 和他的同事基於特權異惡唑支架開發新型且更有效的雙重 FXR/PPARδ 激動劑83 和 84(圖26)
圖26. 雙重調節劑79–84(圖片來源:J. Med. Chem.)。
Takeda G蛋白偶聯受體5 (TGR5) 是另一種膽汁酸受體,用雙重激動劑靶向 FXR和TGR5顯示出治療代謝和慢性肝病的前景。預計這兩種受體的啟用在肝臟和代謝紊亂的治療中具有廣泛的臨床應用。幾種膽汁酸 FXR/TGR5雙重激動劑(例如 INT-767)已被開發並顯示出潛在的臨床應用。最近,Tokuyama等人透過在強效FXR激動劑85和TGR5激動劑86之間開發嵌合化合物,開發了第一個非膽汁酸 FXR/TGR5 雙激動劑(圖27)。
圖27. FXR/TGR5雙激動劑87和88(圖片來源:J. Med. Chem.)。
4. 結論
由於FXR的重要生物學功能,藥物化學家已經使用高通量篩選、先導最佳化和基於結構的藥物發現策略開發了有效的合成配體。目前有幾個臨床候選藥物正在進行臨床試驗,例如OCA,它處於治療肝硬化和PBC的IV期試驗中。
根據臨床前和臨床資料,FXR激動劑和拮抗劑都對代謝疾病具有有益的治療效用。FXR激動劑已用於治療PBC、PSC、T2DM (NCT04702490)和NASH,而FXR拮抗劑用於治療糖尿病腎病 (104702490)和1098T型肝炎 (NCT04702490) C病毒 (HCV) 感染 (NCT01492998)。根據其化學結構,FXR激動劑分為甾體或非甾體。大多數類固醇類BA候選藥物顯示出不良副作用。因此,在發現第一個強效激動劑GW4064 後,學術實驗室和製藥公司更加關注開發非甾體激動劑。這些努力取得了成功,多個候選藥物進入了臨床試驗,包括基於GW4064設計的 GS-9674、LY2562175、LMB763和LNJ-452。儘管GW4064是在20年前發現的,但 GW4064仍然是FXR激動劑藥物發現的主要先導化合物,GW4064的主要結構修飾摘要和過去幾年用於調整該模板的PK/PD 特性的最重要片段是圖28中提供。
圖28. GW4064 的結構修飾總結和用於替換其關鍵結構元件的最重要片段 [GW4064 分為六個片段:頭部基團、接頭1 (L1)、中心環 (CR)、接頭2 (L2)、末端環(TR)和羧基] (圖片來源:J. Med. Chem.)。
人們對開發針對FXR和其他具有類似結構的藥物靶標的雙重調節劑越來越感興趣。這種方法是一種新穎且有前景的策略,可以發現代謝或腸肝疾病的多因素候選藥物,這些候選藥物也可能對抗純FXR激動劑的代謝副作用。INT-767是第一個FXR/TGR5雙重激動劑,目前正在進行肝纖維化的臨床試驗。最近,公開了雙 FXR/sEH調節劑,我們的團隊和其他人目前專注於發現雙FXR/PPARδ 激動劑,以最大限度地發揮有益的協同作用並減少不良副作用。然而,平衡雙重目標的親和力以最大限度地減少不利影響仍然是一項重大挑戰。
另一種對抗FXR激動劑副作用(包括血脂異常)的方法是考慮與其他藥物(貝特類藥物或他汀類藥物)聯合治療,以改善對血脂的影響。某些副作用(例如,瘙癢)的機制基礎也有待確定,並且是避免或抵消FXR激動的這種後果的高度優先事項。因此,需要在該領域進行更多研究,以開發新穎且安全的雙調製器。
參考文獻
https://doi.org/10.1021/acs.jme