新藥開發是在第一項專利提交後與時間賽跑,瞭解從首次人體研究到監管批准的潛在時間對戰略規劃至關重要。Noel Southall等使用從美國FDA審查檔案中收集的資訊來深入瞭解過去十年成功的藥物開發計劃的時間表。研究人員將臨床開發時間定義為從首次人體臨床研究開始到監管上市許可之間的天數,Noel Southall等專注於創新藥物的開發——那些首次上市的產品包含新的分子實體或新的活性部分。Noel Southall等還調查了FDA監管計劃如何影響這一過程。
臨床開發時間分析
2010-2020年FDA批准的藥物。 2010年至2020年間,440種創新藥獲FDA批准上市。其中,35種創新藥沒有提供臨床開發開始日期:10種藥物沒有提供研究性新藥(IND)申請的原始提交日期,25種藥物的初始臨床開發發生在美國境外,並且首先——無法獲得人體試驗日期。對其餘405種產品的臨床開發時間和其他產品特性進行了分析。開發時間從不到5年到超過20年不等(圖1)。
圖1. 創新藥物的臨床開發時間。在過去十年中,每年藥物佇列的開發時間保持穩定;中位數為8.3年。
臨床開發時間最短的兩種藥物都是小分子藥物:奧希替尼(一種非小細胞肺癌治療藥物)和 elexacaftor(一種囊性纖維化治療藥物)。奧希替尼於2013年3月6日進入臨床試驗,上市產品Tagrisso於2015年11月13日(984天后)獲得加速批准。Tagrisso於2017年3月31日獲得全面批准。
Elexacaftor 的IND於2016年12月12日開放,包括該藥物Trikafta在內的三聯療法於2019年10月21日(1043天后)獲得批准。更令人印象深刻的是,這種非癌症、固定劑量的組合藥物在沒有加速批准的情況下獲得批准。這是 Vertex Pharmaceutical 對囊性纖維化的第四次批准;早期的產品每個都在臨床開發中花費了2000多天,這凸顯了經驗和減少監管不確定性如何加速產品開發。
新藥申請(NDA)提交和批准之間時間最短的藥物是博納吐單抗(75天)和瑞德西韋(76天)。雖然 blinatumomab於2014年12月3日獲得加速批准,但直到2017年7月12日才獲得全面批准。針對COVID-19的瑞德西韋NDA於 2020年8月7日提交,並於2020年10月22日獲得批准。同樣,該計劃也受益於2020 年5月1日獲得事先緊急使用授權。下一個最快的完全批准是卡巴他賽,其滾動NDA提交於2010年3月31日完成,僅在78天后獲得批准。
藥物型別的趨勢
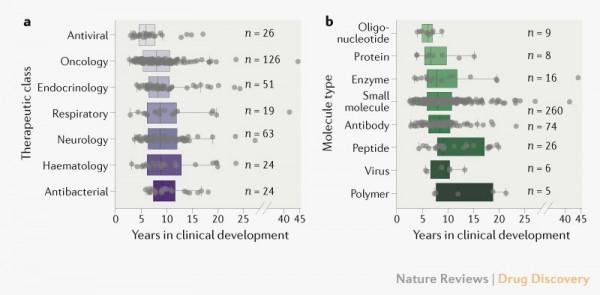
按治療類別分組的近期創新藥物的臨床開發時間揭示了一些有趣的差異(圖2a)。最近的抗病毒產品(n = 26)比其他產品類別的開發時間更短。其他差異更為溫和,可能反映了觀察不同型別疾病的臨床意義益處所需的時間和人口規模的差異。一般而言,每個治療類別中的開發時間存在顯著差異。
圖2.創新藥物的臨床開發時間作為治療類別和分子型別的函式。a ) 藥物型別;單向方差分析 P = 0.04。b )分子型別;單向方差分析 P < 0.01。
分子型別的趨勢
儘管與高度創新技術相關的監管風險,但最近批准的小干擾RNA和反義寡核苷酸產品(n = 9)的開發時間比小分子(n = 260)更短。相比之下,批准的基因治療和病毒產品(n = 6)的開發時間與小分子產品相當。雖然不同的分子型別可能會帶來重要的製造挑戰,但開發時間似乎在很大程度上取決於藥物的臨床背景。
加速計劃對臨床開發時間的影響。 FDA 有廣泛的計劃來促進某些藥物的開發,例如那些有望幫助解決未滿足的醫療需求的藥物。為了估計每個程式對臨床開發的有用程度以及對產品開發過程中所採用的多種機制的控制,作者對臨床開發時間進行建模,並分別對許可申請提交和批准之間的審查時間進行建模,程式和其他協變數使用多元線性迴歸.
加速批准、突破性指定、孤兒指定狀態以及產品批准是否需要一個以上的審查週期都與臨床開發時間顯著相關(表1)。正如預期的那樣,優先審查狀態以及產品批准是否需要一個以上的審查週期與審查時間顯著相關。
控制其他開發因素,典型創新藥的臨床開發時間為9.1年(95%置信區間(CI)=8.2-10.0年)。具有加速批准指定的藥物的臨床開發時間縮短了1100天(95% CI = 563–1,637 天)。突破性指定還與臨床開發時間的減少有關,儘管與其他監管計劃相比,這種影響的程度不太確定:479 天(95% CI = 5-953 天)。
相比之下,孤兒藥指定與臨床開發時間增加 552 天相關(95% CI = 148-957 天)。這表明,儘管試驗規模較小,但此類計劃可能會受到諸如識別和招募患者的挑戰、疾病自然史的不確定性以及開發新臨床終點的潛在需求等問題的阻礙。值得注意的是,在美國,孤兒指定產品有資格獲得 FDA 額外兩年的營銷獨佔權,這抵消了與更長的臨床開發時間相關的額外成本。
收到FDA的完整回覆函以及其他未能在第一個審查週期內獲得批准的情況使審查時間增加了829天(95% CI = 732-926 天),同樣將臨床開發時間增加了 643天(95% CI = 132–1153 天)。
優先審查狀態將審查時間減少了103天(95% CI = 19-187 天);然而,優先審查狀態與總體臨床開發時間沒有顯著相關性。也許分析缺乏足夠的能力來檢測這種相關性。
是否指定快速通道、產品最終是否在標籤上包含黑框警告以及產品是否為診斷顯像劑與開發時間沒有顯著相關性。
結論與展望
臨床開發時間可根據公開資訊計算得出,為產品開發速度提供了一個高階指標。速度對患者和藥物開發商都很重要。FDA的優先審查憑證計劃提供了對其重要性的一種估計。將審查目標日期從10個月縮短到6個月的120天收益最近在公開市場上價值1億美元或更多,估計額外開發時間的成本接近每天100萬美元。
近年來,創新藥物的臨床開發時間保持穩定。大多數產品在臨床開發中花費了十年的大部分時間,而其他產品則花費更長的時間。然而,FDA 的加速開發計劃顯然縮短了從臨床試驗進入到藥物批准的路徑。對於孤兒產品,額外的產品獨佔權抵消了額外的開發時間。
提高臨床試驗能力和試驗設計、患者分層和臨床生物標誌物的創新,以加快藥物開發時間表。由於孤兒藥數量眾多(約佔所有新藥的 40%),而且這些藥物在臨床開發中可能需要更長的時間,因此與罕見病基金會、患者權益團體和風險慈善模型的戰略合作伙伴關係可能被證明對於幫助改進開發時間表。例如,提供訪問組織庫、資料、細胞系、生物標誌物、患者和資金的合作伙伴關係現在對於某些罕見疾病很常見。這已被強調為導致近期囊性纖維化藥物取得成功的重要基石,包括首個可供患者使用的改善疾病的治療方法。臨床開發時間將是衡量這些策略影響的有用指標。
參考文獻
Clinical development times for innovative drugs.
doi: https://doi.org/10.1038/d41573-021