【研究背景】
隨著電池效能的不斷提高,以鋰離子電池為動力的裝置在現代社會中無處不在。然而,它們在材料和化學水平上仍面臨重大挑戰。其中許多挑戰都與電解質有關。電解質的溶劑化結構源於溶質-溶劑相互作用,以往研究的重點主要集中在溶劑分離離子對(SSIPs)、接觸離子對(CIPs)和由一個離子與多個抗衡離子配位組成的小聚集體(AGGs)(圖1a)。除了這些區域性溶劑化結構之外,奈米聚集體,稱之為n-AGG,最近也在各種電解質體系中觀察到。與由幾個離子組成的小AGG不同,n-AGG更大,由數十個和數百個離子組成(圖1b),有些甚至形成離子網路。與區域性溶劑化結構相比,n-AGG為電解質的電化學氧化還原、傳輸和介面特性增加了更多的複雜性。目前,還沒有文獻綜合介紹n-AGG對電解質微觀和宏觀傳輸特性、電子結構、機械強度及其介面結構的影響。
圖 1、(a)溶劑分離離子對(SSIP)、接觸離子對(CIP)和小聚集體(AGG)。(b)奈米聚集體(n-AGGs)。
【工作簡介】
近日, 美國阿貢國家實驗室的Lei Cheng、Larry A. Curtiss等人發表了綜述文章,重點介紹了各種電池電解質中聚集體的發現及其對電解質特性的影響。此外還對這一新興奈米聚集體領域的未來發展進行了展望,並強調了開發新的實驗和計算工具來研究其特性的必要性。相關研究成果以“Beyond Local Solvation Structure: Nanometric Aggregates in Battery Electrolytes and Their Effect on Electrolyte Properties”為題發表在國際頂尖期刊ACS Energy Letters上。
【內容詳情】
n-AGG的形成是由離子-離子和離子-溶劑相互作用的平衡驅動的。由於高的比表面積,n-AGGs與溶劑的表面能阻止了n-AGGs尺寸的進一步增加。在鹽濃度高的電解質中,電解質的靜態介電常數降低,離子間的靜電相互作用隨著鹽濃度的增加而增加,促進了離子聚集體的形成。當LiTFSI水系電解質的濃度高於3 M(mol/kg)時,陽離子-陰離子和陰離子-陰離子對數量變得相當可觀。透過MD模擬、中子散射和光譜技術,能夠在21 M LiTFSI水系電解質(稱為鹽包水電解質(WiSE))中觀察到n-AGG。通常,在電解質中能夠觀察到富含水和富含離子的聚集體(圖2a)。與單價離子相比,含有多價離子的電解質更容易形成n-AGG(圖2b)。四氫呋喃(THF)、二甲氧基乙烷(DME/G1)、二甘醇二甲醚(G2)、三甘醇二甲醚(G3)和四甘醇二甲醚(G4)以及具有較短鏈溶劑的電解質具有更高的團聚趨勢。對於氧化還原液流電解質,氧化還原活性有機分子傾向於透過分子結構中的非極性基團相互作用來排除溶劑,形成擴充套件域(圖2c)。在介電常數相對較低的聚合物介質中,離子之間的靜電相互作用強於離子-溶劑相互作用,這有利於n-AGG的形成。研究人員使用MD模擬在離聚物(Na+中和的聚(乙烯-共丙烯酸)離聚物)中觀察到n-AGG(圖2d)。
圖 2、不同電解質中的n-AGG。(a)20 M LiTFSI水溶液中的水和離子聚集體快照。(b)0.4 M Mg(BH4)2三甘醇二甲醚電解質溶液中的鹽聚集體。(c)1 M二烷氧基芳烴氧化還原聚合物在乙腈中的聚集體。(d)離聚物中的長程結構。
n-AGG的動力學
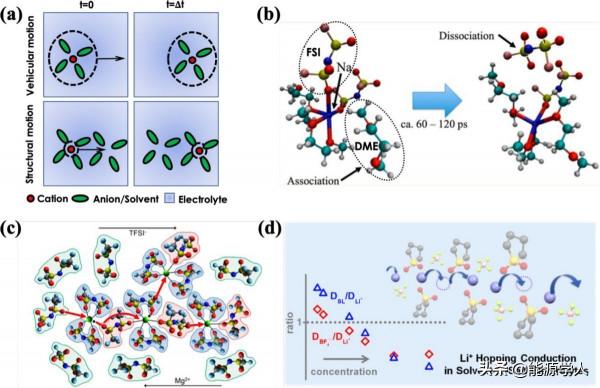
從微觀角度來看,陽離子擴散有兩個組成部分:載體和結構,如圖3a所示。載體運動是指一個離子及其溶劑化殼作為一個實體進行擴散。它通常是稀液體電解質中的主要離子擴散機制。結構運動是指離子透過不同溶劑化殼間連續的離子耦合/解耦進行擴散。陽離子i與溶劑化殼中的溶劑或抗衡離子j之間的特徵擴散長度(Lijc)由陽離子i的自擴散率和溶劑或抗衡離子j在第一個溶劑化殼中的停留時間決定。大的Lijc通常表示載體運動更多,反之亦然。
圖 3、(a)載體和結構運動示意圖。(b)4.12 M NaFSI-DME電解質中配體交換的快照。(c)Mg2+-IL電解質中的結構運動。(d)Li+(DLi)、BF4–(DBF4–)和環丁碸(DSL)自擴散係數之間的比值以及高鹽電解質中的Li+跳躍傳導機制。
透過MD模擬,發現含有n-AGG的高鹽電解質(例如4.12 M NaFSI-DME電解質)中,數十皮秒時間內的配體交換實現了n-AGG內的Na離子擴散,這意味著離子擴散由結構運動主導(圖3b)。在等摩爾NaFSI環丁碸(SL)電解質中,Na+可以透過結構運動擴散,這有助於提高轉移數。研究人員還研究了離子液體和含有n-AGG的多價電解質中的離子傳輸。在Mg(TFSI)2/Pyr14TFSI電解質中,Mg離子透過結構擴散(即透過在相鄰 [Mgn(TFSI)m](m−2n)–簇之間進行交換)移動(圖3c),而MD模擬表明由於Mg-TFSI配位結構的停留時間較長,載體對Mg2+運輸的貢獻會變得更加明顯,如果Mg2+被Zn2+取代,在中等金屬陽離子濃度下不會形成n-AGG。在高濃度的LiBF4環丁碸電解質中,Li離子的擴散速度比BF4–陰離子和SL溶劑快。拉曼光譜和MD模擬結果表明,鋰離子擴散更快是因為鋰離子透過將BF4–陰離子和SL溶劑作為配體進行跳躍傳導(圖3d)。n-AGG中的離子運動是有限的,因為龐大的聚集體結構相對固定。電解質中n-AGG的出現通常會導致離子的遷移方式從載體運動轉變為結構運動,並減慢離子擴散,降低電導率。然而,除了自擴散和離子電導率外,電解質的極限電流還受到遷移數的影響,它與離子傳輸機制高度相關,透過最佳化遷移數有望提高電池的能量和功率密度。
電子、機械和介面特性
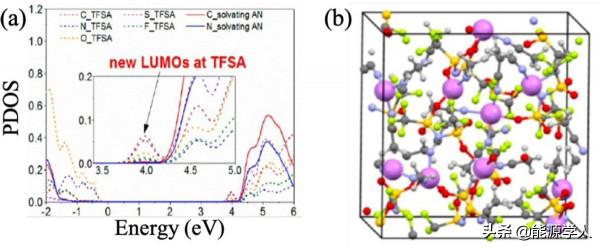
n-AGG中離子的獨特溶劑化結構可能導致能帶變化。例如,透過對投影態密度(PDOS)的分析,Yamada等人發現,由於與多個Li+相互作用,TFSI的最低未佔分子軌道(LUMO)低於溶劑的能級(圖4a)。由於陰離子的LUMO降低,鹽的還原分解發生在溶劑之前,導致陰離子衍生的固體電解質介面(SEI)形成,降低了介面電阻並延長了電池的迴圈壽命。從圖4b所示的溶液結構中可以清楚地觀察到n-AGG和陰離子與一種以上陽離子配位的溶劑化結構。n-AGG的形成改變了電子結構,從而改變了電解質組分的氧化還原穩定性,導致SEI組分發生變化。
圖 4、4.2 M LiTFSI乙腈電解質溶液的(a)投影態密度(PDOS)和(b)快照。
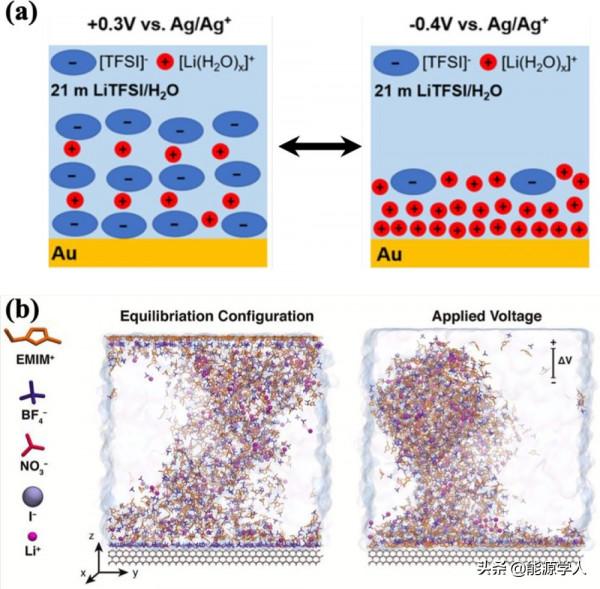
對具有n-AGG的電解質的介面研究主要集中在介面附近的結構變化,包括雙電層(EDL)。研究人員使用超微電極測量和電位相關的原子力顯微鏡(AFM),發現在WiSE和金的介面處,[Li(H2O)x]+([TFSI]-)y離子對可以在正電勢下富集,形成6.4–6.7 Å的雙電層,而當施加負電勢時,[Li(H2O)x]+富集,形成2.8–3.3 Å的電荷層(圖5a),表明水合溶劑殼內的陰離子和陽離子分別在正電位和負電位處富集。最近在對Li-O2電池的研究中發現,當對溶解了0.2 M O2的電解質施加外部偏壓時,n-AGG在EDL中延伸,這是由於電解液在電場中的重新定向和排列導致(圖5b)。由於O2很容易停留在富含溶劑的區域,因此n-AGG的重新定向和排列會改變O2在反應介面上的可及性。這些例子表明n-AGG在帶電介面上發揮著特別強的溶劑化結構導向作用,可用於控制特定物質在電極表面的可及性,從而調控電荷轉移動力學和電化學穩定性。
圖 5、(a)施加不同電位時,WiSE中電極表面的雙電層示意圖。(b)Li-O2電解質在有或沒有偏壓情況下,介面的快照。
【結論】
本文從計算和實驗研究兩個方面闡明瞭n-AGG的結構及其對電解質理化性質的影響。儘管如此,關於電解質與n-AGG的結構-性質關係仍有很多不瞭解的地方。例如,WiSE中n-AGG的確切形態仍不清楚,而這會最終影響整體的離子傳輸特性。同時,對介面處n-AGGs的研究也很少,它們對EDL結構、離子去溶劑化過程和電解質的不可逆分解,以及形成機制、組成,以及SEI的結構有著顯著影響。最後,需要建立控制n-AGG的設計原則,以便可以有針對性地提高電池電解質的效能。
Zhou Yu, Nitash P. Balsara, Oleg Borodin, Andrew A. Gewirth, Nathan T. Hahn, Edward J. Maginn, Kristin A. Persson, Venkat Srinivasan, Michael F. Toney, Kang Xu, Kevin R. Zavadil, Larry A. Curtiss, and Lei Cheng. Beyond Local Solvation Structure: Nanometric Aggregates in Battery Electrolytes and Their Effect on Electrolyte Properties. ACS Energy Letters. 2021, DOI:10.1021/acsenergylett.1c02391