將外源基因匯入靶細胞的方法有很多,其中一種比較普適、成功率又比較高的方法為顯微注射法。
首先,我們說說這種方法的原理:顯微注射法即是利用管尖極細(0.1至0.5μm)的玻璃微量注射針,將外源基因片段直接注射到原核期胚或培養的細胞中(如圖1中所示),然後藉由宿主基因組序列可能發生的重組、缺失、複製或易位等現象而使外源基因嵌入宿主的染色體內,實現宿主細胞的基因改造。
一般的動物細胞,直徑大約10微米左右;人類真核細胞直徑範圍在:3~30微米,其中人卵細胞直徑約為100微米。故直徑為0.2微米的顯微注射器針頭可以為各種型別和任意大小的動物細胞提供精確的、重複性良好的細胞內和細胞旁註射。在注射的過程中,動物細胞膜也會被刺破。但因為動物細胞膜良好的彈性和流動性,在細胞膜被刺破以及細胞內注入或者抽取點物質之後,細胞膜還是可以恢復完整的,恢復好的細胞可以繼續存活,正常生長。當然操作手法也會影響實驗的成功率,針對不同細胞的操作手法方面的研究,現在也有很多文章發表出來。
顯微注射技術的長處為:任何DNA在原則上均可傳入任何種類的動物細胞內,對於所轉的外源基因沒有長度上的限制,目前已證明數百kb的DNA片段均可以成功轉入靶細胞並整合進其染色體組。
現在,我們來歸納一下顯微注射法的應用:
- 顯微注射法可用來做轉基因動物:顯微注射技術是利用顯微作業系統和顯微注射技術將外源目的基因直接注入到受精卵的原核中,使外源基因整合到受體細胞的基因組內,再透過胚胎移植技術將整合有外源基因的受精卵移植到受體動物的子宮內發育,從而獲得轉基因動物。顯微注射法是目前轉移效率基較好的一種基因轉移方法,可直接用不含有原核載體DNA片段的外源基因進行轉移;外源基因的長度不受限制, 可達100kb ;實驗週期相對比較短。它的不足之處是 :匯入外源基因整合位點和複製數無法控制;常導致插入位點附近宿主DNA 片段缺失、重組等突變,可造成動物嚴重的生理缺陷。儘管如此,由於顯微注射技術直接對基因進行操作,整合率較高,因而仍是目前建立轉基因動物極為重要的方法。
- 顯微注射法在植物、動物的細胞發育研究的應用:將特定的分子探針及衍生的細胞間質成分匯入活體細胞,為研究控制細胞功能的調控機制提供了新的視野。
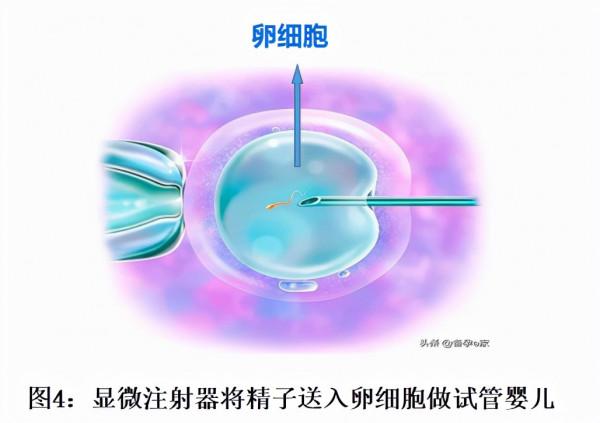
- 顯微注射法在體外受精過程中的應用:在做試管嬰兒體外受精的過程中,一般會在取卵後4—5小時將處理後的精子與卵子放在同一個培養皿中共同培養18小時後,在顯微鏡下觀察受精情況。若精子質量太差,無法自然受精,則必須以顯微注射法強迫受精(如圖4所示)。
- 顯微注射法用於做克隆動物:供體細胞的細胞核用顯微注射器移入卵母細胞後,在卵母細胞相關因子的作用下,發生了重程式設計回覆到發育的起點狀態。核重程式設計的過程就是使在體細胞中被關閉,而在正常胚胎髮育中表達的基因重新被啟用的過程。
重程式設計有三種可能的結果:
1,供核基因組完全沒有進行重程式設計,重構胚很快死亡;
2,部分重程式設計,重構胚在不同的發育階段死亡 ;
3,完全重程式設計,產生正常的克隆動物。
- 顯微注射器可以實現單細胞提取:在不改變細胞生存環境的情況下,用顯微注射器對單個細胞進行活細胞提取。可單獨提取細胞質或細胞核,或者同時提取提取細胞質和細胞核。提取後細胞仍可存活。相比於傳統的裂解方式,用顯微注射器提取的樣本更為乾淨,可以得到很好地電鏡影象。
- 顯微注射法可以實現更優的CRISPR-Cas轉染方式:顯微注射器能夠進行高速、高效地將CRISPR-Cas複合物注入細胞,幫助您克服對於傳統方式極難轉染的細胞基因編輯問題。
顯微注射法的缺點是:實驗所需的裝置精密而昂貴、操作技術需要長時間的練習,以及每次只能注射有限的細胞。
本文關於顯微注射法的介紹就到此為止。顯微注射法是改造基因的基本技術之一,很多後續更尖端的改造基因的技術都建立在此技術之上。基因改造計劃是一個很有前景的計劃,在人類社會的發展程序中註定要起到很重要的作用,在以後的文章中我們還會陸續探討這方面的話題和技術。感興趣的朋友可以點選關注本號,大家共同學習、交流探討:)
謝謝讀者們的閱讀!