細胞藥物開發的複雜水平
撰文:步步先生
首發:幹細胞者說
● ● ●
細胞治療正如雨後春筍般興起,為諸多難治性疾病提供了一條有效治療途徑。全球正在活躍的細胞治療臨床試驗共有1705項(其中,T細胞767項;幹細胞620項、DC細胞136項、NK細胞佔116項、菌群48項、紅細胞39項、單個核細胞27項和血小板7項)。
這裡的“臨床試驗”限定在美國臨床試驗資料庫(ClinicalTrials.gov)註冊,狀態為尚未招募、招募的臨床試驗,是指活躍的臨床試驗。(本文資料截止2020年8月)
1 T細胞臨床試驗
在過去十年中,T細胞臨床試驗增加變得突飛猛進,這歸功於CAR-T療法的巨大成功。目前,T細胞是所有細胞治療臨床試驗中研究最多的細胞型別,佔總臨床試驗的45%。
臨床試驗中T細胞療法的現狀。
767個T細胞臨床試驗:基因修飾(GM)或非基因修飾(NGM)T細胞。GM類臨床試驗分為:CAR-T細胞;TCR-T細胞或其他。同樣,NGM類臨床試驗分為:病毒特異性T細胞;TAA特異性T細胞或其他。
1 GM類T細胞臨床試驗
T細胞臨床試驗大約77%屬於GM細胞。GM類T細胞臨床試驗分為:CAR-T細胞、TCR-T細胞或其他。
第一類,當然是CAR-T療法。
T細胞臨床試驗63%都是CAR-T細胞。目前獲批CAR-T療法靶點主要是CD19,但CD19僅佔37%,其他靶點包括BCMA、CD22和CD20。所有這些靶點加上CD19,佔CAR-T試驗的58%,這說明B細胞癌的適應症繼續佔主流。雙靶點CAR-T療法,治療血液瘤的一種思路。兩種不同靶點出現在同一細胞上,或兩種不同的CAR-T產品共同輸注。這種策略可能降低複發率(透過靶向和消除對CD19靶向治療耐藥的癌細胞)。
實體瘤靶點不明確、T細胞浸潤不足和腫瘤微環境的存在,這導致CAR-T治療實體瘤基本無效。CAR-T臨床試驗中,約24%屬於實體瘤。最常見的靶點是GD2(神經母細胞瘤和黑色素瘤)、間皮素(間皮瘤和卵巢癌、胰腺癌、結腸癌等)、HER2(轉移性乳腺癌)和GPC3(肝癌)。靜脈給藥,CAR-T治療實體瘤最常見的給藥途徑(75%)。當然,也有其他給藥途徑,如腹腔內、腦室內/腔內、瘤內、肝內動脈、胰腺內(經脾靜脈或動脈),還有胸腔內給藥。預防T細胞衰竭、提高靶向特異性和促進組織浸潤的設計,是CAR-T治療實體瘤成功的關鍵。
第二類,就是TCR-T細胞。
T細胞臨床試驗12%屬於TCR-T細胞。TCR-T臨床試驗大約81%的靶點是實體瘤獨有的。常見適應症,包括肝細胞癌、黑色素瘤和頭頸部鱗狀細胞癌。TCR-T細胞大多為自體(88%)
第三類,經基因修飾的T細胞。這類T細胞通常進行過基因修飾,可誘導自殺基因、受體表達或細胞因子等治療有效載荷的分泌。主要使用異體細胞。這類T細胞亞群包括Treg、TIL和Th。
2 NGM類T細胞臨床試驗
T細胞臨床試驗大約24%屬於NGM類T細胞。NGM類T細胞臨床試驗分為:病毒特異性T細胞(VST)、TAA特異性T細胞(TAA-T)或其他。
第一類是病毒特異性T細胞(VST)
VST通常是異體(70%),細胞通常從配型好的移植供體中分離,或從病毒感染康復後的供體中分離。VST用於治療癌症、移植相關病和感染病。VST可用於消除病毒誘導的癌症。VST還可用於治療造血幹細胞移植後發生的病毒感染。最常見的靶點是鉅細胞病毒和EB病毒。VST也可用於治療與癌症和移植無關的病毒感染(如HIV和SARS-CoV-2)。
第二類是TAA特異性T細胞(TAA-T)
TAA-T主要是自體(74%)。NY-ESO-1、PRAME和尿生物素是最常見的靶點。TAA-T可進行個性化治療,產品由多個治療TAAs的細胞混合物組成,可直接從患者中分離出來。TAA-T臨床試驗大約有2/3用於治療實體瘤。
非靶向佔NGM類T細胞臨床試驗的40%,包括各種沒特定靶點的T細胞。通常來源外周血,包含TIL和Treg等。TIL主要用於實體瘤治療。Treg主要用於治療GVHD和自身免疫病。
2 幹細胞臨床試驗
幹細胞一直處於細胞治療臨床領域的前沿。目前,幹細胞佔目前所有細胞臨床試驗的36%,範圍涵蓋10個主要適應症。幹細胞臨床試驗的細胞來源包括HSC(44%)、MSCs(46%)、神經幹細胞(2%)、骨髓幹細胞(3%)和其他。
臨床試驗中幹細胞療法的現狀。
620個幹細胞臨床試驗,分類:a)造血幹細胞;b)間充質幹細胞;c)神經幹細胞;d)骨髓幹細胞;e)其他(心臟幹細胞、角膜緣幹細胞和內皮祖細胞)
1 造血幹細胞臨床試驗
造血幹細胞佔幹細胞試驗的44%,主要用於造血幹細胞移植。大多數造血幹細胞臨床試驗(69%)適用於紅細胞相關病,其餘適應症包括實體瘤、與白細胞相關的非惡性血液病、免疫缺陷、自身免疫和移植相關疾病。大多數造血幹細胞試驗(61%)使用異體細胞,因為需用健康供體造血幹細胞替代患者的惡性免疫細胞。細胞通常來源於配型好的供體骨髓血或臍帶血。自體細胞移植的優勢是排異風險低,患者耐受性好。
1)適應症:腫瘤
主要適應症是血液瘤(51%),大多數使用異體細胞(71%)。目前,基因修飾的造血幹細胞(GM-HSC)療法尚未獲得FDA批准,正在臨床進行安全性和有效性研究。另一種適應症是實體瘤(大約佔9%)。大約58%的臨床試驗利用自體細胞。因為在實體瘤中,目標是增強現有的免疫系統。值得注意的是,所有實體瘤的3期臨床試驗(26%)均用於治療腦轉移或神經外胚層癌。
2)適應症:紅細胞相關病
適應症是與紅細胞相關疾病(大約佔18%),適應症包括鐮狀細胞病、貧血和地中海貧血等。NGM-HSC療法主要使用異體細胞(64%),而GM-HSC療法僅使用自體細胞(36%)。這是因為自體GM-HSC可以在體外進行修飾,以表達正確的靶基因序列,從而生成含有功能蛋白的細胞。歐盟EMA 批准 2 種基於GM-HSC的細胞和基因療法,Strimvelis 用於腺苷脫氨酶缺乏症 (ADA-SCID),Zynteglo 用於治療輸血依賴性地中海貧血症。
3)適應症:免疫相關的病
適應症是用於與白細胞和免疫缺陷相關的非惡性血液疾病。在一小部分試驗(4%)中,造血幹細胞用來探索治療自身免疫病。適應症包括多發性硬化症(MS),系統性硬皮病和克羅恩病。數量較少,但晚期試驗的相對比例較高。
2 間充質幹細胞臨床試驗
間充質幹細胞(MSCs)佔幹細胞臨床試驗46%。MSCs來源包括骨髓、脂肪、臍帶華爾通氏膠和胎盤等。大多數MSCs療法都採用異體細胞(65%),MSCs“現貨型”產品已成為未來發展趨勢。根據關鍵作用機制。MSCs臨床試驗大致分為兩類:組織修復和免疫調節。
1)組織修復
MSCs臨床試驗大約32%集中在組織修復應用。退行性病變是一個重要應用方向。使用MSCs治療骨關節炎有30項試驗。一種用於治療骨關節炎的自體脂肪MSCs產品JointStem,已經證明了安全性和初步有效性。神經退行性疾病也是MSCs治療的一個方向。其中有7項用於阿爾茨海默病,2項用於帕金森病,3項用於亨廷頓病。此外,退行性病變方面的適應症還包括椎間盤退行性變、衰老性虛弱等。創傷修復也是MSCs治療的另一個重要方向,有23項試驗(8%)。目前正在研究創傷性腦損傷、脊髓損傷、急性腎損傷、缺血再灌注損傷等。
2)免疫調節
MSCs臨床試驗大約49%集中在免疫疾病的治療。MSCs療法的第二大疾病是自身免疫病(18%),包括類風溼性關節炎(RA)、1型糖尿病(T1DM)、多發性硬化(MS)、系統性紅斑狼瘡(SLE)等。MSCs在非自身免疫病中也擁有前景廣闊(14%)。正在進行的適應症包括支氣管肺發育不良、肝硬化、急性和慢性胰腺炎、慢性阻塞性肺疾病(COPD)和腎小球腎炎的治療。
MSCs臨床試驗大約13%用於感染病。隨著COVID-19大流行,MSCs已經進入治療SARS-CoV-2感染的臨床,已有兩項試驗進入了2/3期。Remestemcel-L就是一種代表,最初用於兒童aGvHD,現在正在進行用於治療COVID-19 引起的ARDS的3期臨床試驗。
MSCs臨床試驗大約4%用於治療移植相關疾病。比如用於治療aGvHD和器官移植排斥反應,尤其是肝、腎和肺。
3 其他幹細胞
其他幹細胞(包括神經幹細胞、骨髓幹細胞、心臟幹細胞、內皮祖細胞、角膜緣幹細胞和多能成體祖細胞等),僅佔10%。應用範圍相對狹窄。神經幹細胞的適應症包括星形細胞瘤、膠質瘤、帕金森病、視網膜色素變性和脊髓損傷。肺幹細胞的適應症包括特發性肺纖維化和間質性肺疾病,用於視網膜色素變性的視網膜祖細胞,以及用於免疫調節的多能成體祖細胞。
3 DC和NK細胞臨床試驗
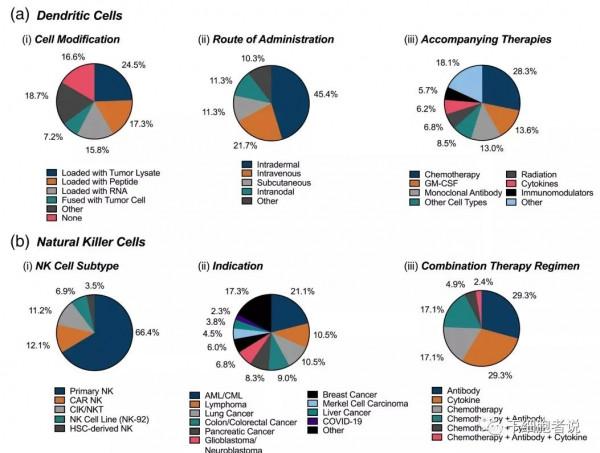
DC細胞和NK細胞臨床試驗的現狀。
a)136項DC細胞臨床試驗;b)116項NK細胞臨床試驗。
DC臨床試驗
DC疫苗是臨床試驗的熱門領域,大約93%的臨床試驗用於癌症治療,其餘適應症包括自身免疫病、感染病和移植相關病。
大多數DC試驗(89%)使用自體細胞。異體細胞適應症主要在白血病和肝移植。DC疫苗試驗包括給藥途徑、免疫刺激分子的新增和其他聯合藥物方案。DC疫苗最常見的給藥途徑是皮內注射(45%),而靜脈注射(22%)、皮下注射(11%)和血管內注射(11%)也可使用注射。
DC可以聯合施用刺激分子,包括生長因子(GM-CSF)、細胞因子(IL-2)和單抗(抗PD-1/PD-L1)使用,可促進DC向淋巴結的擴張和運輸,啟用T細胞和NK細胞,或使癌細胞對細胞毒性T細胞敏感。常見的伴隨療法包括化學療法、其他細胞型別(幹細胞、T細胞)、免疫調節劑和放射療法。
NK細胞臨床試驗
在過去幾年中,NK細胞越來越火爆。這歸因於NK細胞的天然細胞毒性、非MHC限制性和“現貨型”的使用能力。目前,NK細胞試驗佔細胞治療試驗總數的7%。NK細胞來源包括異體外周血(53%)、自體外周血(27%)、NK細胞系(15%)和幹細胞(5%)。
儘管,外周血NK細胞仍然是主要來源(80%),但是原代分離數量少(即NK細胞僅佔外周血白細胞的5%-10%)和體外擴增困難。幹細胞衍生細胞產品和細胞系是一個思路,解決了細胞來源和規模化擴增問題。通常,CAR-NK細胞被認為比CAR-T細胞更安全,因為NK細胞在體記憶體活期更短,也不太可能誘發嚴重的副作用。CAR-NK細胞通常產生IFN-γ和GM-CSF,而CAR-T細胞產生一組細胞因子(IL-1a、IL-2、IL-6、TNF-α、MCP-1、IL-8、IL-10、IL-15和其他),引起細胞因子釋放綜合徵和嚴重神經毒性。
1)細胞種類
NK細胞試驗包括NK細胞、CAR-NK細胞、CIK、NK細胞系(NK-92)和iPSC/HSC-NK細胞。
NK細胞試驗大多數(66%)使用未經基因修飾的NK細胞,主要是利用其固有的細胞毒性。CAR-NK療法(12%)由於CAR-T產品上市後,取得了令人鼓舞的成果。CAR-NK細胞療法用於血液瘤(CD19、BCMA和CD22);實體瘤(ROBO-1、PSMA和間皮素);COVID-19(ACE-2)。另一個主要細胞類是CIK(11%),具有NK-T雜交細胞表型,以非HC限制性方式執行。CIK也被稱為II型NKT細胞。在這裡,理解為NKT細胞即可。與天然NK細胞相比,NK-92細胞系(7%)易於擴增和轉染。最後,iPSC/HSC-NK細胞(4%)可以克服PBMC來源NK細胞細胞數量的限制。
2)適應症
適應症主要是癌症(95%),其次是感染病(4%)。NK臨床試驗佔血液瘤的比例較大,急性/慢性髓性白血病(AML/CML)21%,淋巴瘤11%。值得注意的是,NK細胞治療實體瘤的臨床試驗要比血液瘤要多。通常使用CAR和聯合治療方法來提高靶向性,克服惡性腫瘤(如膠質母細胞瘤)。一部分NK細胞試驗(35%)採用透過聯合給藥或給藥後輔助治療的策略。抗體和細胞因子是最常用的輔助治療(兩者均為29%),其次是化療藥物,以及這些藥物的組合。
4 其他細胞臨床試驗
單個核細胞臨床試驗
單個核細胞的臨床試驗較少(佔2%)。這裡的單個核細胞包含以下細胞群之一:單核細胞(佔單個核細胞試驗的11%)、巨噬細胞(佔單個核細胞試驗的0%)、BMMC(佔單個核試驗的52%)和PBMCs(佔單個核試驗的37%)。
最常見的適應症是心血管疾病(39%)和癌症(29%),有些應用於創傷(14%)。大多數(89%)這些試驗中的大多數使用自體細胞。許多臨床前研究使用單核細胞和巨噬細胞作為治療方法,通常用於治療癌症、自身免疫病和炎性疾病。
值得注意的是,單核細胞透過白細胞分離,然後分化為DC進行再注射。由於其高度可塑性,單核細胞非常適合於體外調節,用於在再注射前誘導表型變化。BMMC和PBMC也被納入臨床試驗。因為它們包含了不同的細胞群,可以分泌各種因子來促進傷口癒合和再生。與單核細胞/巨噬細胞類似,這些細胞體外可以誘導表型變化。也可以富集或去除單個核細胞裡某些細胞群(如幼稚T細胞或B細胞)。
紅細胞和血小板
臨床試驗也在進行靜脈輸注供血產品(如紅細胞、全血和血小板)。紅細胞佔總試驗的2%,血小板佔總試驗的0.4%
紅細胞臨床試驗中,最常見的適應症是血液疾病,如貧血(26%)和鐮狀細胞病(18%)。紅細胞適應症還有肺癌、乳腺癌和瘧疾感染。值得注意的是,在7項試驗中,紅細胞(2個自體和5個異體)被用作藥物載體,攜帶和傳遞膜結合或封裝藥物運輸到靶點。通常採用靜脈回輸給藥方式。血小板輸注被用於血小板減少症和創傷後凝血的誘導。通常,血小板均採用靜脈注射的。
微生物臨床試驗
微生物的臨床試驗現在有48項(佔總試驗的3%)。基本流程包括:從健康患者糞便中收集微生物,去除有害成分(如病毒、病原體),以分離某些或全部的特定微生物。通常透過口服膠囊給藥。糞便菌群移植(FMT)雖然可用於臨床治療,但並沒有作為藥品開發的,因此FMT臨床試驗沒有統計。
5 文末小結
細胞療法是當今醫學研究最前沿也是最熱門的方向之一,取得了令人興奮的成果。每一項成功的臨床試驗,背後都有紮實的基礎研究作為鋪墊,其中涉及細胞本身的生物學特性、適應症的選擇,給藥方式的選擇,細胞的選擇和給藥的劑量,這些都是成功的非常關鍵因素。
我們如果能夠從成功案例中總結制定一套完善的評價標準,便可將其推廣到其他細胞和基因治療中,推動其發展。任何事物的發展都將遇到挑戰和阻礙,我們仍然相信細胞治療將克服困難,成為可靠的治療方式。
參考文獻
Wang LL, Anselmo AC, Mitragotri S, etc. Cell therapies in the clinic. Bioeng Transl Med. 2021
誰持彩練當空舞 :幹細胞基礎與臨床研究進展
— END —
- 科普 情懷 責任 -