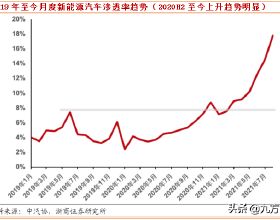
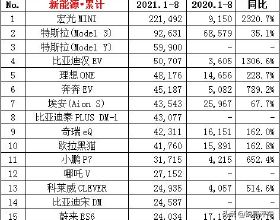
歡迎關注凱萊英藥聞
1月5日,創新藥開發公司Sutro Biopharma宣佈,旗下靶向葉酸受體α(FolRα)的抗體偶聯藥物(ADC)STRO-002劑量擴充套件1期臨床試驗中期結果積極。
該劑量擴充套件1期臨床試驗納入了44名至多接受過3線治療的卵巢癌患者,其中,81%的患者對鉑耐藥,63%和65%的患者曾分別接受過貝伐珠單抗和PARP抑制劑治療。43名患者被隨機分配至4.3mg/kg和5.2mg/kg初始給藥劑量組,另有一個患者尚未給藥。43名已給藥患者中,33名患者至少進行過一次基線後檢查,因此,可進行RECIST v1.1應答評估。
1)截至中期資料提取日2021年11月8日,33名可評估最佳總體應答(BOR)患者情況如下:
a.經至少兩次基線後檢查確認,7名患者產生部分應答(PR)。
b. 中期資料提取日前僅接受過一次基線後檢查的患者中,5名患者產生未確認的部分反應(PRu),中期資料提取日後接受基線後檢查顯示,4名患者確認產生部分應答(PR)並且其中疫苗患者病情穩定(SD)。
c. 33名可評估患者的客觀應答率(ORR)為33%,11名患者產生部分應答(PR),兩種給藥劑量水平下受試者的FolRα表達水平均不高。
d. 14名患者病情穩定(SD),8名患者出現進展性疾病(PD)。
2)17名初始給藥劑量為5.2 mg/kg且生物標記物水平不高的患者中觀察到劑量反應,ORR為47%,8名患者產生部分應答(PR)。
3)腫瘤比例評分(TPS)、FolRα表達水平與應答率呈正相關:
a. 同生物標記物檢測搭配,TPS已被確定為接受STRO-002治療的潛在篩選方法。
b. TPS>25%的患者中,觀察到ORR為40%(25名患者中有10名PR),而TPS≤ 25%的患者ORR僅為13%。
4)Sutro Biopharma提供的資料顯示,FolRα表達水平高且TPS>25%的人群約佔晚期卵巢癌患者約70%。
5)5.2 mg/kg和4.3 mg/kg初始給藥劑量下,43名安全性可評估患者的安全性訊號與劑量遞增佇列的資料一致。
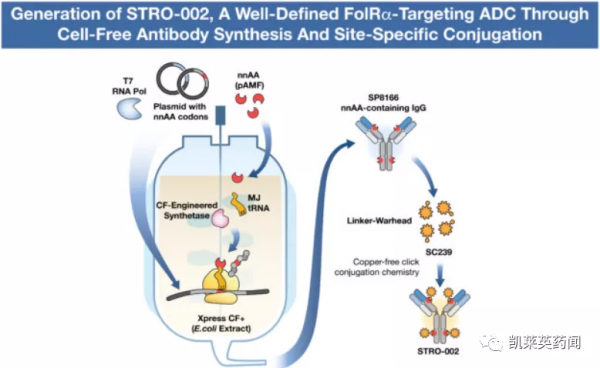
STRO-002正在歐美開展針對復發卵巢癌和子宮內膜癌的一期臨床研究,復發卵巢癌劑量爬坡研究已於2020年8月完成,已獲FDA授予治療卵巢癌的快速通道資格。STRO-002的靶點FolRα具有腫瘤細胞特異性,在卵巢癌、子宮內膜癌、乳腺癌和非小細胞肺癌等腫瘤組織中高表達,是ADC藥物的潛在適合靶點。STRO-002採用的連線子為蛋白酶可裂解的Val-Cit-PABA,其小分子荷載為海洋提取物哈米特林的衍生物,是一種新型微管抑制劑和P糖蛋白泵的弱底物,具有抵抗耐藥的潛力。
2021年12月,天士力醫藥集團股份有限公司宣佈控股子公司天士力生物醫藥股份有限公司向Sutro支付4,000萬美元首付款和潛在最高3.45億美元的開發及商業化里程碑付款,以及約定比例的銷售額提成,獲得STRO-002大中華地區(中國大陸、香港及澳門特別行政區、臺灣地區)獨家開發、註冊、商業化權益。