T細胞急性淋巴細胞白血病(T-ALL)是一種兒童和成人共患的血液系統癌症,缺乏有效的靶點和靶向藥物。支鏈氨基酸(BCAAs)是纈氨酸(Val)、亮氨酸(Leu)和異亮氨酸(Ile)的統稱,是一類側鏈帶有分支結構的必需氨基酸。BCAAs在癌症的發生發展過程中發揮重要作用,可以透過蛋白合成和代謝等途徑促進慢性粒細胞白血病和急性粒細胞白血病的進展。
在細胞中,氨基酸和轉運RNA(tRNA)在相應的tRNA合成酶催化下結合,運輸到正在翻譯mRNA的核糖體上,透過反密碼子和mRNA的密碼子配對結合,在核糖體的催化下合成蛋白質。近來,有研究表明tRNA的合成水平和腫瘤進展相關,但是其中的機制仍不明確。
2021年12月22日,紐約大學醫學院的Iannis Aifantis 團隊在Nature上發表了題為《Valine tRNA levels and availability regulate complex I assembly in leukaemia》的文章,發現T-ALL中NOTCH1透過上調Val-tRNA合成酶VARS的表達上調Val-tRNA;限制飲食中Val水平能夠降低T-ALL小鼠的Val-tRNA水平,從而緩解白血病、增加小鼠存活率。機制上,Val限制降低了線粒體複合體I亞基mRNA翻譯速率,導致複合體I組裝缺陷和氧化磷酸化受損。該研究發現了Val-tRNA的表達失調是T-ALL進展過程中的關鍵步驟,揭示了Val-tRNA促進T-ALL的分子機制,為膳食干預T-ALL提供了理論基礎。
在T-ALL中Val-tRNA生物合成發生改變
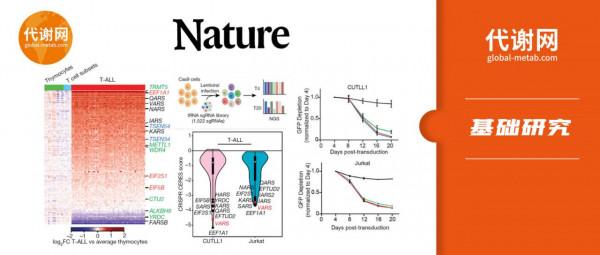
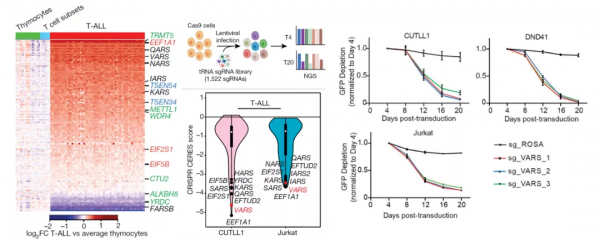
作者分析了T- ALL、正常胸腺細胞(非成熟T細胞)和成熟T細胞亞群的基因表達資料集,發現T-ALL的表達譜與另外兩者有顯著的差異,很多參與tRNA生物合成的基因在T-ALL中有顯著上調。接下來,作者針對tRNA生物合成相關基因進行了CRISPR陰性篩選,發現Val-tRNA合成酶VARS的sgRNA顯著消耗,提示VARS表達上調、Val-tRNA合成上調。表達譜資料也顯示T-ALL中VARS mRNA和Val-tRNAs(尤其是tRNA-Val-TAC)顯著上調。tRNA-Val-TAC是誘導細胞快速分裂的促增殖性tRNA。靶向突變tRNA-Val-TAC使其失去mRNA配對能力後,多個T-ALL細胞株的增殖能力顯著降低。
NOTCH1直接調控Val-tRNA合成酶VARS的表達
在T-ALL中NOTCH1突變是重要的驅動性突變,有研究發現NOTCH1訊號可上調tRNA生物合成和蛋白合成相關基因的表達。那麼T-ALL中的Val-tRNA上調是否和NOTCH1訊號有關呢?
作者透過GRO-seq檢測了新增NOTCH1抑制劑γSI和隨後移除γSI不同時間後細胞的新合成RNA譜。K-means聚類顯示有兩個響應γSI處理的基因簇,這些簇包括MYC和IL7R等NOTCH1的靶基因和參與tRNA生物合成的基因。其中,VARS和tRNA-Val-TAC-1-1的新生RNA在新增γSI後表達顯著下調,去除γSI後表達水平逐漸復原,提示NOTCH1影響VARS和Val-tRNA的合成。NOTCH1抑制劑可以下調VARS蛋白水平。ChIP-seq進一步發現NOTCH1可以和VARS的啟動子結合。這表明NOTCH1直接參與調控VARS的表達,並進一步影響Val-tRNA水平。
限制Val攝入可以緩解T-ALL
上述結果表明,T-ALL高度依賴於細胞中的Val-tRNA庫。考慮到Val是一種必需氨基酸,必須透過飲食攝取,那麼低Val飲食能否干預T-ALL的進展呢?
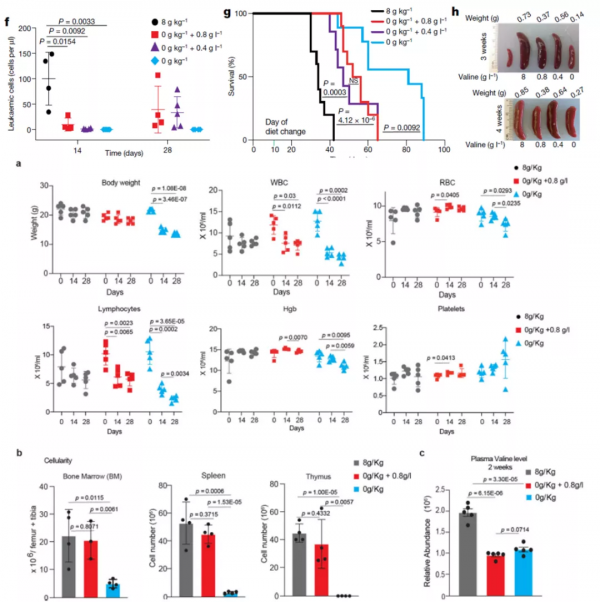
作者構建了NOTCH1-ΔE-GFP移植T-ALL小鼠模型。與對照組 (8 g/kg; 0.8% Val)相比,Val缺乏飼養小鼠血液中和脾臟中的癌細胞數顯著降低。在Val缺乏飼養T-ALL小鼠的飲用水中重新新增Val後,白血病細胞重新出現,表明限制Val攝入能緩解T-ALL。Val缺乏飼養顯著降低了T-ALL 小鼠的腫瘤負擔,但是不影響BCR-ABL融合的B-ALL小鼠的癌症進展,表明Val對T-ALL有特異性。
作者進一步探索了Val飲食剝奪是否對人類T-ALL有效。作者對移植了NOTCH1突變患者來源的T-ALL原代細胞的免疫缺陷小鼠進行Val缺乏飲食,發現Val缺乏可顯著緩解T-ALL小鼠的白血病和脾臟腫大,顯著延長了T-ALL小鼠的生存率。
上述結果表明T-ALL細胞對飲食中Val水平敏感,Val剝奪可以改善T-ALL。
適當限制飲食中的Val可以既緩解T-ALL又克服Val缺乏的不良後果
雖然Val剝奪有利於改善T-ALL,但是有研究顯示長期飲食剝奪Val會導致體重減輕、造血功能受損。那麼,能否將飲食中的Val降低到既能影響T-ALL進展又能避免不良反應的水平呢?
給小鼠以對照飼料或Val缺乏飼料+正常飲用水、Val缺乏飼料+不同Val濃度飲用水(0.8g/L和0.4g/L)的處理,作者發現Val缺乏飼料+不同Val濃度飲用水能顯著延長T-ALL小鼠的存活率。其中,Val缺乏飼料+0.8 g/L Val飲用水是最佳條件,該條件下小鼠的生存時間顯著延長但是沒有明顯的體重損失。血漿Val定量分析表明,在Val缺乏飼料+0.8 g /L Val飲用水餵養2周後,血漿Val水平降低了約50%。作者進一步檢測了該條件下小鼠的造血功能,發現0.8 g/L Val不改變小鼠的紅細胞和血小板計數,不改變骨髓、脾臟和胸腺的細胞數量。此外,對骨髓和胸腺的分析顯示,Val缺乏飼料+0.8 g /L Val飲用水飼餵的小鼠中T細胞發育和造血是正常的。上述實驗表明,適當限制飲食中的Val水平可以延緩T-ALL的進展,同時能避免Val剝奪的不良後果。
Val限制飲食條件下
T-ALL細胞對Val需求上調
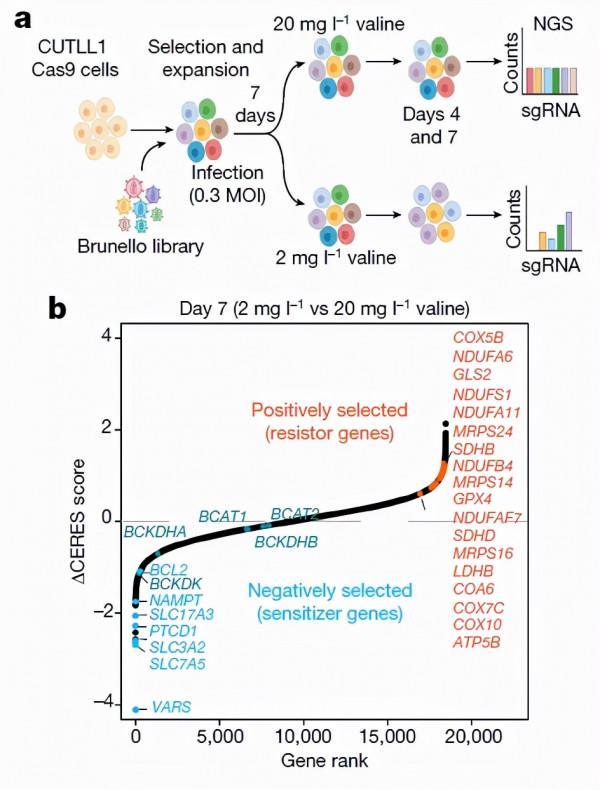
為了進一步探究Val限制飲食對T-ALL的影響,作者在體外模擬了Val限制並進行了全基因組CRISPR陰性篩選,發現在低Val條件下,VARS 表達上調,介導BCAAs轉運的基因SLC7A5和SLC3A2、BCAA代謝的相關基因BCKDK和GLS2上調。這些變化表明T-ALL細胞對Val的有較高的需求,VARS、SLC7A5和SLC3A2具備成為T-ALL治療靶點的潛力。
Val水平影響電子傳遞鏈mRNA的翻譯
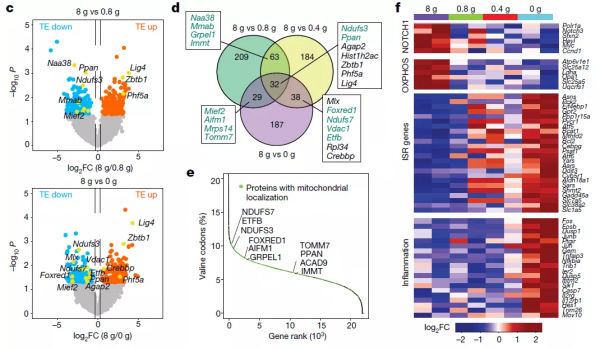
為了瞭解Val限制飲食緩解T-ALL的分子機制,作者評估了不同Val飲食的小鼠中分離的脾原細胞中mRNA翻譯差異,鑑定了162種在低Val條件下差異翻譯mRNA。STRING網路分析發現這些差異翻譯mRNA在電子傳遞鏈(ETC)相關的過程中富集,包括NADH脫氫酶活性和線粒體複合體I的生物合成。
對人類蛋白質組的分析表明,線粒體蛋白質普遍富集Val密碼子,其中一些在Val限制條件下翻譯下調。這提示Val含量高的蛋白的mRNA翻譯過程對Val剝奪更敏感。作者透過實驗發現NDUFB1(含有12% Val)-GFPd2報告基因的表達比NDUFS55(含約1% Val)-GFPd2報告基因的表達對纈氨酸剝奪更為敏感。
在轉錄水平上,Val限制下調NOTCH1、MYC和β-catenin訊號通路的基因表達水平,上調與凋亡、炎症和摺疊蛋白反應相關的基因。值得注意的是,SLC7A5和BCL2的表達水平在Val限制條件下均顯著上調,提示SLC7A5和BCL-2表達上調是其抗Val限制的潛在機制。
Val限制導致ETC複合體I損傷
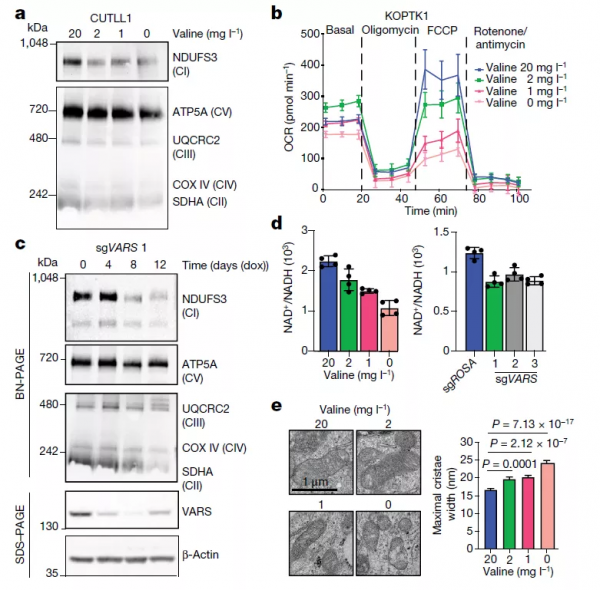
為了進一步探索Val限制飲食是否影響ETC功能,作者在Val限制培養基中培養T-ALL細胞株,發現ETC複合體(特別是複合體I)的蛋白水平明顯降低,細胞耗氧率顯著降低。靶向敲除VARS mRNA也導致複合體I的下調。Val限制和VARS敲除導致的NAD+/NADH下降進一步表明複合體I發生了功能損傷。電鏡觀察發現,Val限制和VARS敲低均導致線粒體嵴腔寬度增加和結構紊亂。這些結果表明Val限制或VARS敲低抑制Val-tRNA的合成,導致複合體I損傷、NAD+/NADH比值降低和線粒體形態、功能異常。
總結
tRNA在腫瘤的發生發展過程中有重要作用,然而tRNA促進腫瘤的分子機制仍不明確。作者以T-ALL為切入點,發現Val-tRNA是維持T-ALL的重要因素。T-ALL中Val-tRNA合成顯著上調;Val限制飲食或抑制Val-tRNA合成酶的活效能顯著緩解T-ALL,延長T-ALL小鼠的壽命;選擇合適的低Val飲食能在不損傷機體正常生理功能的情況下顯著緩解T-ALL、延長生存期。在機制上,T-ALL中常見的NOTCH1訊號啟用使NOTCH1和VARS啟動子結合,促進Val-tRNA的合成;Val限制飲食後,線粒體蛋白的mRNA的翻譯受到顯著抑制,ETC複合體I顯著受損,線粒體功能發生缺陷,細胞增殖受到抑制。該研究闡明瞭tRNA生物合成影響腫瘤進展的分子機制,發現了Val限制飲食靶向治療T-ALL的潛力。