文章來源:中華醫學會腸外腸內營養學分會腦健康營養協作組,阿爾茨海默病腦健康營養干預專家共識撰寫組,徐俊,石漢平.阿爾茨海默病腦健康營養干預專家共識.中國科學雜誌2021,12(51):1762-1788
正文
隨著全球老齡化程度日益加劇, 阿爾茨海默病(Alzheimer’s disease, AD)等與衰老相關的神經退行性疾病在疾病譜中的位置不斷前移. 世界衛生組織(World Health Organization, WHO)報告指出, 2015年全球罹患痴呆的人數約為4747萬[1]; 國際阿爾茨海默病協會(Alzheimer’s Disease International, ADI)預測2030年這一人數將增至8200萬, 2050年將超過1.52億[2]. 我國最新流行病學調查顯示, 60歲以上1507萬痴呆人群中, AD患者高達983萬(65.23%)[3]. 2016年全球疾病負擔研究表明, 痴呆是全球第五大死亡原因(240萬), 由此造成的傷殘調整壽命年高達2880萬[4]. 2015年, 全球痴呆醫療照護成本約高達8180億美元, 其中85%的費用來自非醫療護理的家庭和社會支出[5]. 這些均提示AD相關認知障礙是老年人死亡和失能的重要原因, 亦給社會和家庭帶來沉重負擔.
《“健康中國2030”規劃綱要》明確提出: 努力實現“以健康為中心”的戰略轉變和主動應對“健康老齡化”的戰略需求[6]; “預防腦衰老, 保持腦健康”已成為健康老齡化的高階目標. 王擁軍等人[7]於2020年撰寫的“腦健康提案”中將腦健康定義為: 具有年齡相當的最佳整合功能、精神和認知功能, 且無影響腦正常功能的顯性腦疾病. 該定義的提出強調了多維度、多學科合作對監測和管理腦功能、促進腦健康的重要意義. 為進一步落實“領航營養、健康中國”理念, 2020年 8月, 中華醫學會腸外腸內營養學分會(Chinese Societyfor Parenteral and Enteral Nutrition, CSPEN)成立了腦健康營養協作組. 國家衛生健康委釋出的《探索老年痴呆防治特色服務工作方案》也明確, 要對基層醫院、社群和二級以上綜合醫院不同認知障礙階段的老年AD人群制定分層分級的營養干預措施[8].
自AD命名的120年以來, 其主要治療手段仍以膽鹼酯酶抑制劑(cholinesterase inhibitors, ChEIs)和N-甲 基-D-門冬氨酸(N-methyl-D-aspartate, NMDA)受體拮抗劑為代表的神經遞質環路的對症支援治療為臨床診療依據. 2019年11月, 我國藥品監督管理局批准甘露特鈉膠囊(GV-971)上市用於治療輕至中度AD, 提出了靶向“腸道菌群-腸-腦軸”降低全身和神經炎症損害, 從而改善認知功能的創新機制[9]. 成年人腸道菌群主要有厚壁菌(51%)、擬桿菌(48%)、變形桿菌和放線桿菌(1%)四類; 隨著衰老和膳食營養變化, 腸道菌群的多樣性和組成發生明顯改變[10]. 新近研究證實, 腸道菌群失調普遍存在於AD相關認知障礙, 甚至輕度認知障礙(mild cognitive impairment, MCI)患者中[11]. 改良地中海-生酮飲食模式可透過影響腸道菌群調節短鏈脂肪酸生成, 降低MCI患者腦脊液中與AD相關生物標誌物水平(Aβ40, Aβ42, T-tau和P-tau181)[12]. 縱向研究結果揭示了某些營養素(如維生素B12、同型半胱氨酸)或地中海飲食模式(Mediterranean-type diet, MeDi)與腦容量或腦完整性之間的關係[13,14]; 終身營養對老年人認知功能有直接影響[15]. 這些證據強烈提示特定膳食模式與營養干預作為可調節因素在促進腦健康和預防AD中的潛在研究價值. 2020年12月, 第十四屆CSPEN會議再次強調, 營養治療可影響身體、心理、社會角色、靈性及經濟五個方面, 具有顯著改善臨床結局和節約醫療費用的雙重作用[16]. 重視AD腦健康的營養干預不僅可以進一步豐富和完善臨床診療規範, 對減輕AD所致社會經濟負擔亦具有重要意義.
近年來, 對營養與AD相關認知障礙的認識不斷提高, 但目前臨床對AD腦健康營養干預的理念嚴重滯後: (ⅰ) 神經病學、營養學、老年醫學等在AD的多學科綜合管理體系亟待建立; (ⅱ) 老年高危人群、MCI以及AD患者各階段營養問題的識別和干預欠缺規範; (ⅲ) 基於特定飲食模式和特殊醫學用途食品(簡稱特醫食品)(food for special medical purposes, FSMP)的研究證據有限, 結論不一; (ⅳ) 現代膳食結構和生活方式帶來的影響認識不足; (ⅴ) 國人營養風險的篩查評估、診斷治療、隨訪評價體系仍未建立. 本共識經由腸外腸內營養學會、老年醫學學會認知障礙分會、中國卒中學會腦健康分會等多位中國認知障礙和營養領域專家們反覆討論, 透過對PubMed、Scientific Index、萬方、維普以及知網等國內外資源的痴呆/營養相關文獻進行薈萃分析, 根據2011版牛津循證醫學中心證據分級標準確認證據級別和推薦意見級別(表1),借鑑國外AD營養相關研究和管理經驗, 對中國AD腦健康營養干預提出指導建議, 以加強臨床醫生對AD患者各階段營養風險篩查和干預策略的規範管理, 為患者和照料者提供參考和指導意見, 為我國的老年痴呆防治營養干預特色提供依據.
AD腦健康的干預現狀
1.1 AD的“三級”預防近些年, AD的遺傳和發病機制等研究領域取得諸多進展, 其中“腸道菌群-腸-腦軸”等創新理論強烈提示AD是多因素、多靶點參與的複雜性系統性疾病. 重視營養、生活方式以及危險因素調控等非藥物干預, 將其作為預防或延緩AD的基本措施, 提高腦認知儲備、減少腦損傷, 可預防或延緩35%~40%的痴呆患病[17,18].鑑於此, 本共識在目前國際上普遍認可的AD一級和二級預防的基礎上, 提出AD的“三級”預防策略.
(1) 零級預防. 零級預防指透過全人群健康干預,全面預防疾病相關危險因素的出現, 從而提高人群的健康水平[19]. 我國中國工程院院士吳以嶺曾提出: “起居有常、營養均衡、身心保養”是作為疾病零級預防最簡單直接、成本最低的管理策略. 然而, 目前國際上對AD相關認知障礙的零級預防認識尚淺, 我國缺乏疾病零級預防的系統性預防體系, 人們對現代膳食結構和生活方式改變所帶來的影響亦不夠重視[20,21]. 這就要求認知障礙、營養學以及老年醫學等多學科領域專家和臨床醫生本身意識到良好的營養和平衡的膳食及其干預策略在AD相關認知障礙病程中的重要地位, 並對老年人群及其照料者進行健康宣教和科普培訓, 以加強這類人群養成良好生活習慣、均衡膳食和身心放鬆的健康意識, 儘可能地在早期干預以預防或延緩AD發生.
(ⅰ) 營養不良對AD的影響貫穿疾病全程. 2015年, 歐洲腸外腸內營養學會(European Society for Clinical Nutrition and Metabolism, ESPEN)指南提出, 痴呆患者最突出的營養相關狀況是體重下降和營養不良,這兩種改變可出現在疾病各個階段, 且隨著疾病進展更加明顯[22]. 研究表明, 老年人短期內出現不明原因體重下降被認為是AD臨床前期表現[23,24], 輕至中度AD患者體重可減輕30%~40%[25]. 一項納入8個低至中收入國家的橫斷面研究(國際10/66研究)顯示, 痴呆嚴重程度與體重下降之間的直接聯絡存在階梯效應, 即二者之間的關係隨著痴呆進展逐漸增強[26]. 前瞻性多中心研究顯示, 與營養狀況正常的臨床前期和臨床期AD患者相比, 營養不良的AD患者病程進展比例更大;營養不良是疾病進展的獨立危險因素(OR: 2.4, 95%CI:1.1~5.1)[27]. 與輕至中度患者相比, 重度AD患者營養不良風險更高, 體重和體重指數(body mass index, BMI)均較低[28]. 一項長達6.5年的前瞻性佇列研究表明, AD患者體重快速下降(6個月內下降≥5 kg)可作為死亡的預測因素[29]. 由此可見, 營養不良對AD的影響可貫穿疾病起始、進展以及預後全過程, 儘早營養干預對預防或延緩AD相關認知障礙營養不良甚至疾病發生十分重要.
此外, 照料者有責任保證AD患者的飲食環境和營養狀況, 但對其體重變化、營養攝入不足、更高的營養需求有許多負擔和憂慮. 佇列研究顯示, 無論是基線還是隨訪1年後, 營養不良組照料者負擔均明顯增加[30]. 另一方面, 照料者本身的壓力和負擔也增加了AD患者的營養問題: 縱向研究表明, 照料者負擔與AD患者厭食行為惡化明顯相關[31], 且明顯加重輕至中度AD患者短期內體重下降的風險[32], 形成惡性迴圈. 因此, 重視對照料者的營養健康宣教和營養技能培訓可能更有意義, 而這一點在臨床常常被忽略.
推薦意見: 營養不良對AD的影響貫穿疾病起始、進展以及預後全程, 其與AD疾病進展和照料者負擔之間均存在嚴重的惡性迴圈(Ⅱ級證據, B級推薦).
(ⅱ) AD患者營養不良的原因. 首先, AD患者出現體重下降和營養不良的原因尚不十分明確, 可能與生理和認知衰弱、疾病本身發病機制以及特殊臨床表現等有關. 由各種因素引起的與衰老相關的多個器官或系統儲備和功能下降的複雜臨床綜合徵稱為衰弱, 主要表現為不明原因體重減輕、疲乏感、握力降低、步速減慢以及體能下降[33]. AD作為衰老相關疾病可出現明顯衰弱, 衰弱亦會導致或加劇MCI和AD相關認知障礙[34~36]. 同時, 衰弱與營養不良之間也相互影響: 老年住院患者衰弱或衰弱前階段與營養不良及其發生風險顯著相關[37], 營養不良所致不良預後更可能與生理衰弱有關[38]. 2013年, 國際營養與衰老研究所和國際老年病學協會提出“認知衰弱”的概念, 即老年人同時出現MCI和生理衰弱的臨床綜合徵[39]. 橫斷面研究顯示,認知衰弱與營養不良和抑鬱明顯相關[40], 進一步揭示AD、衰弱和營養不良之間的密切聯絡.
其次, 諸多研究強調特定腦區的神經退化過程、遺傳因素以及炎性改變在AD患者體重下降中的作用.AD早期下丘腦的CA1區萎縮可透過影響患者食慾調節和飲食行為損傷能量平衡[41]; 邊緣系統損害也與AD患者低BMI相關[42,43]; 在認知功能下降早期甚至發病數年前, 嗅覺系統的病理變化被認為是導致營養攝入減少和體重下降的原因[44]. 載脂蛋白E(apolipoproteinE, APOE)ε4等位基因可能與AD患者體重減輕和BMI下降有關[45]. 此外, 研究發現, Aβ沉積可啟用腦內星形膠質細胞和小膠質細胞產生促炎細胞因子, 透過影響調控飽食與攝食中樞的下丘腦的葡萄糖敏感神經元來抑制進食[46]. 與衰老相關的慢性炎症改變可透過上調白細胞介素6和C-反應蛋白等炎性分子水平, 促使肌肉質量、力量以及功能喪失引起肌肉減少症和衰弱, 從而加重營養不良[47].
再次, AD患者在不同階段由於認知障礙、精神行為症狀(behavioral and psychological symptoms ofdementia, BPSD)或咀嚼吞嚥障礙等不同臨床表現導致營養不良(表2)[22]. 在痴呆前階段(包括臨床前AD和MCI), 患者可能因為嗅覺和味覺下降、食慾改變而影響攝食量; 輕度痴呆階段, 因認知功能下降, 患者忘記進食或準備食物能力下降等導致營養攝入不足; 隨著疾病進展, 患者出現各種BPSD, 如淡漠使得食慾減退和活動下降, 有研究究表明, 淡漠是AD患者體重減輕的危險因素[48]; 另一方面, 患者也無法提供激越、譫妄等過度活動所需的能量, 出現體重下降和營養不良[49]. 疾病晚期, 患者由於喪失進食能力、吞嚥困難等出現營養不良.
最後, AD患者受累腦區突觸丟失和功能紊亂是疾病特異性病理改變, 被認為是神經元丟失前的早期機制. 突觸丟失促使突觸更新需求增加, 從而導致患者對特定的營養素需求更高[50]. 隨機對照試驗顯示, Souvenaid(一種FSMP)對大腦功能連線有良性影響, 給予輕度AD患者Souvenaid營養干預來支援突觸功能可能與提高記憶力有關[51], 提示營養與AD突觸功能的相關性. 綜上, AD患者一方面需要攝入足夠的能量與營養素來滿足病理生理過程以及BPSD所需的高營養需求,另一方面需要補償因攝入不足和吸收下降所致的營養不良, 即呈現疾病特異性營養需求.
推薦意見: AD病程各階段均可出現營養相關狀況, 建議進一步開展基礎和臨床研究以闡明AD患者出現營養不良和體重下降的確切機制以及營養干預能否改善AD患者臨床認知症狀(專家共識).
(ⅲ) 營養與AD發病機制的關係. AD是多因素、多病理途徑參與的複雜腦疾病綜合徵, 營養作為環境因素可從多方面影響疾病發生髮展. 進行性神經元和突觸缺失是AD早期的重要特徵. 磷脂是構成包括突觸膜在內的神經細胞膜的主要成分, 二十二碳六烯酸(docosahexaenoic acid, DHA)作為ω-3多不飽和脂肪酸(omega-3 polyunsaturated fatty acid, ω-3PUFAs)最重要的成分之一, 高度富集在突觸質膜和突觸囊泡的磷脂中[52]. 研究顯示, 給予Kennedy途徑的底物(即尿苷、DHA和膽鹼)不僅可以增加膜磷脂的合成[53], 還可以透過提高突觸蛋白水平、促進神經突起生長以及增加樹突棘密度等方式促進突觸形成[54]. 補充B族維生素(葉酸、維生素B12和B6)可增加膽鹼和DHA的利用率,進而促進神經細胞膜磷脂合成[55,56]. 這些證據提示, 聯合補充多種營養素(DHA、膽鹼、磷脂、葉酸、B族維生素等)可透過提供營養前體物質和輔助因子來支援神經細胞膜的形成和功能, 以補充AD所致的突觸減少和功能喪失以及膜相關病理改變[57,58].
其次, 小膠質細胞和星形膠質細胞介導的神經炎性改變是AD患者腦組織的另一個重要特徵[59,60]. “腸道菌群-腸-腦軸”對腦功能和腦健康的影響是近年來一大研究熱點. 臨床研究發現, MCI和AD患者有相對特定的腸道菌群譜, 尤其是具有抗炎活性的脆弱擬桿菌和直腸真桿菌含量明顯下降[11,61]. 腸道菌群失調可透過改變菌群多樣性、釋放代謝產物、調節胃腸訊號分子和神經遞質等多途徑誘發機體代謝改變和慢性炎症應答, 進一步誘導神經炎性改變, 影響AD發生發展[62,63]. 飲食中富含的特定營養素、進食節律以及餵養方式等均能調節腸道菌群的組成和多樣性, 影響腦功能[64]. 研究顯示, MeDi膳食模式可透過促進擬桿菌和普氏菌等益生菌增殖, 同時降低厚壁菌和變形桿菌比例[65], 下調神經炎性改變和氧化應激反應, 從而延緩AD患者認知功能下降[66,67].
此外, 近年來強調了表觀遺傳學在AD發展與營養關係之間的重要作用. DNA甲基化、組蛋白修飾和非編碼RNA(noncoding RNAs, ncRNAs)是AD病理生理學中主要的表觀遺傳學機制. 營養與膳食是參與AD表觀遺傳途徑與其相關的環境因素[68]. 突觸可塑性、學習、記憶、神經元基因表達的調節、神經元的存活和修復都依賴於DNA甲基化; 維生素B12參與甲硫氨酸迴圈, 其缺乏可降低S-腺苷甲硫氨酸水平, 干擾DNA甲基化過程[69]. 報道稱, DHA透過參與組蛋白去甲基化過程以及降低組蛋白去乙醯化酶濃度影響學習和記憶[70]. 鋁是一種與神經退行性病變和晚發性AD有關的強效神經毒素, 可以透過影響某些ncRNAs和氧化應激機制干擾神經元活性[71].
推薦意見: 膳食營養可能透過Kennedy途徑增加神經細胞和突觸膜的完整性, 調節腸道菌群多樣性和組成靶向“腸-腦”軸, 以及參與表觀遺傳學等途徑多層面影響AD的發生發展(專家共識).
推薦意見: 鼓勵開展臨床和基礎研究以探討良好的營養和平衡的膳食是否能作為AD相關認知障礙的零級預防策略(專家共識).
(2) 一級預防. AD的一級預防是指早期識別可調控的危險因素並積極干預, 以預防或延緩疾病發生.AD的危險因素分為不可干預因素和可干預因素, 前者主要包括年齡、性別、父母家族史和遺傳因素, 其中最重要的危險因素就是衰老. 研究顯示, 65歲及以上人群中痴呆發病率呈指數增長, 約80%痴呆患者年齡在75歲以上[72,73]. 這一方面可能是衰老促使海馬萎縮、Aβ失衡以及與記憶相關腦區神經元衰退所致[74],另一方面也可能與老年患者共病率增加以及不同臨床表現之間相互作用有關. AD的可干預因素大致分為生活方式與居住環境、受教育程度和經典血管危險因素3類. 2020年, 賈建平團隊[3]納入我國12個省46011名60歲以上人群的橫斷面研究發現, 痴呆和MCI的9個可干預危險因素分別是居住環境(農村)、低教育程度、獨居、婚姻狀況(喪偶/離異)、吸菸、高血壓、高脂血症、心臟疾病、腦血管疾病. 同年, 鬱金泰團隊[75]基 於243項前瞻性觀察研究和153項隨機對照試驗的系統回顧和薈萃分析確定了21條幹預建議用於AD預防, 19條Ⅰ級推薦中A級證據共10條, 分別與認知活動、晚年(>65歲)BMI、糖尿病、腦創傷、中年(<65歲)高血壓、直立性低血壓、高同型半胱氨酸血癥、抑鬱、壓力和教育有關. The Lancet最新發布的痴呆危險因素是在2017年報道的低教育程度、中年高血壓、聽力障礙、吸菸、中年肥胖、晚年抑鬱、缺乏體育鍛煉、糖尿病和社會接觸少這9個危險因素基礎上, 再增加3個痴呆危險因素: 過度飲酒、創傷性腦損傷和空氣汙染[4,18].
推薦意見: 早期識別並積極干預痴呆危險因素, 如低教育程度、糖尿病、高血壓、創傷性腦損傷、抑鬱狀態、吸菸、肥胖、高同型半胱氨酸血癥等有利於降低或延緩AD發生(Ⅰ級證據, A級推薦).
(3) 二級預防. 2017年, 歐洲防治AD協作組發表了關於臨床前AD認知功能干預專家共識, 提出該階段是最佳治療或干預時間窗[76]. 與其他疾病的二級預防不同, AD的二級預防是指早期發現特徵性病理生理改變並在臨床前階段進行干預, 以識別高危無症狀人群[21].然而, 如何進行早期干預卻沒有明確可行的推薦方案.國家老齡化與老年痴呆協會(National Institute onAging—Alzheimer’s Association, NIA-AA)提出的ATN(amyloid, tau, and neurodegeneration)研究框架寄希望於對臨床前AD進行有效干預, 但目前國內絕大多數醫院因患者來源、檢測水平以及裝置配置等各方面限制無法在臨床診治中常規應用ATN分類系統[77]. 因此, 將良好的膳食和均衡的營養(零級預防)和危險因素干預(一級預防)作為AD的主要預防措施以減少或延緩疾病發生似乎更切實可行.
1.2 AD藥物及非藥物治療策略
2020年初, 我國發布了AD患者“ABC全面管理”專家共識, 強調對患者認知功能(cognition)下降、精神行為(behavior)異常及日常生活能力(activity)減退三大類症狀領域綜合管理的重要性, 以及重視藥物與非藥物治療相結合的總體治療原則[78]. 現階段, AD藥物治療主要分為改善認知功能和控制BPSD兩大類, 其中改善認知功能的藥物主要包括ChEIs, NMDA受體拮抗劑以及二者聯合使用. ChEIs適用於各階段AD, 不僅可以改善認知功能、整體印象以及日常生活能力, 對精神症狀的改善亦有一定作用[79]; 但現有證據顯示, ChEIs並不能改善MCI患者認知功能下降, 且存在許多安全性問題[80]. 以美金剛為代表的NMDA受體拮抗劑適用於中至重度AD患者, 可以改善患者認知功能、日常生活能力、全面能力甚至BPSD[81]. 與二者單藥治療相比,美金剛與ChEIs聯合用藥治療中至重度AD患者, 不僅可以延緩認知功能下降, 改善總體認知功能, 也具有良好的耐受性[82]. 此外, 2019年末, 中國國家藥品監督管理局批准新藥甘露特鈉膠囊(GV-971)用於輕至中度AD, 改善患者認知功能[9]. 最新發布為期36周的多中心隨機雙盲Ⅲ期臨床試驗結果顯示, GV-971可持續改善認知功能, 並具有良好的安全性和耐受性[83]; 但該藥在真實世界的有效性和安全性仍需進一步研究證實.
美國食品藥品監督管理局(U.S. Food and DrugAdministration, FDA)尚未批准任何藥物用於AD的BPSD治療, 目前臨床所用藥物均屬於超適應症使用(off-label), 需遵循個體化、低劑量起始、緩慢增量、短期使用和密切監測等原則[84]. BPSD治療應以抗痴呆藥物為基礎: 多奈哌齊可改善患者焦慮、抑鬱和情感淡漠; 美金剛則在改善妄想、激越、攻擊、嚴重的刻板行為等方面療效顯著[85,86]. 在此基礎上, 如果非藥物干預無效或患者BPSD加重或出現藥物安全問題,才考慮使用控制精神症狀的藥物[87]. 控制精神症狀藥物主要包括不典型抗精神病藥物(如利培酮、阿立哌唑、奧氮平等)和選擇性5-羥色胺再攝取抑制劑類抗抑鬱藥物(如氟西汀、帕羅西汀、西酞普蘭等)兩類.此外, 非藥物治療策略作為藥物治療的有效補充, 一定程度上改善AD患者的“ABC”症候群[88], 主要包括認知干預、BPSD的非藥物調控、日常生活能力訓練、物理療法、運動療法、傳統醫學以及照料者支援等[78].
推薦意見: 建議明確診斷AD的患者選用ChEIs(多奈哌齊和卡巴拉汀), 中重度AD患者可以選用美金剛或美金剛聯合ChEIs改善認知功能和日常生活能力(Ⅰ級證據, A級推薦).
推薦意見: 甘露特鈉可用於改善輕中度AD患者的認知功能(Ⅱ級證據, B級推薦).
推薦意見: BPSD治療需要充分考慮患者的臨床獲益和潛在風險個體化用藥, 在抗痴呆藥物基礎上增加非藥物干預或抗精神症狀藥物(Ⅱ級證據, B級推薦).
2 營養干預具體策略
2.1 重視AD患者營養不良的三級診斷
(1) 營養風險篩查和評估. 老年人群普遍存在“營養衰弱”風險, 這種狀態是持續且動態變化的, 若不及時有效地干預可導致失能, 增加致殘率和死亡率[89].多中心橫斷面研究顯示, 早期營養篩查和更好的營養護理可以降低營養不良發生率[90]. ESPEN指南提出,應該對任何65歲以上老年人進行營養風險篩查, 尤其是同時存在衰弱、慢性非傳染性疾病(如糖尿病、腫瘤等)、獨居、依靠社會服務或日常生活需要生活機構幫助的老年人以及住院患者[91]. 對於認知障礙科門診就診及住院患者而言, 應該在其首次就診即進行營養風險篩查; 對於已確診AD的患者而言, 應在疾病診斷、開始治療以及症狀波動時進行篩查, 記錄基線時營養狀況. 經篩查提示為高營養風險人群, 需要進一步完善營養評估, 為隨後的營養不良診斷與分級, 以及制定營養管理計劃提供臨床依據(圖1). 經篩查未提示存在營養不良風險者, 需常規門診隨訪, 隨訪頻率以1~3個月1次為宜. 營養評估主要包括病史採集(現病史, 營養史, 社會心理學病史, 能量、蛋白和液體的攝入)、人體測量(身高、體重變化、BMI、身體成分)、營養方面體格檢查(一般外觀、頭髮、面板、眼睛、嘴巴、指甲、肌肉或皮下脂肪丟失的跡象以及微量營養素缺乏的表現)、實驗室檢驗(微量營養素、生化指標等)和功能狀態(身體活動、日常生活能力)[92].
目前, 尚無為AD患者設計的廣泛使用且涵蓋所有代謝條件的的營養篩查和評估工具. 大量研究證據顯示, 營養風險篩查-2002(nutrition risk screening-2002,NRS-2002)和營養不良通用篩查工具(malnutrition universal screening tool, MUST)在成人(18~90歲)研究中的預測結果方面表現良好[93,94]. ESPEN評估比較二者臨床應用價值發現, MUST與ESPEN營養不良定義標準有更好的相關性, 即在風險篩查期間, MUST可以更有效地識別營養不良患者[95]. 對老年人(≥65歲)而言,ESPEN推薦使用營養評價精法(mini-nutritional assessment, MNA)完整版和簡易版(mini-nutritional assessment short-form, MNA-SF). 這兩個量表彌補了MUST和NRS-2002量表中缺乏功能性評估、心理和認知引數的缺點, 且MNS-SF因既有完整版預測能力又有測量耗時少的優點在臨床更廣為推薦使用[94,96]. 其他營養風險篩查工具還包括營養不良篩查工具(malnutrition screening tool, MST)和短期營養評估問卷(shortnutritional assessment questionnaire, SNAQ), 它們在篩查營養不良風險方面與NRS-2002具有相似的準確性[97]. 主觀總體評價(Subjective Global Assessment,SGA)、MNA和老年營養風險指數(geriatric nutritionrisk index, GNRI)是專門為老年人開發的營養狀況評估工具, 且在大多數國家都得到了很好的驗證[98]. 對於痴呆中晚期患者而言, 如果存在主動進食障礙或BPSD所致進食行為異常, 可以採用愛丁堡痴呆進食評價問卷(Edinburgh feeding evaluation in dementiaquestionnaire, EdFED-Q)[99,100]和進食行為評估量表(eating behavior scale, EBS)等工具評估以便協助決策進食和營養問題[101,102]. 值得注意的是, 量表涉及的問題應該由照料者或專業護理人員回答, 以便獲得可靠的資訊並儘量減少誤判.
推薦意見: 建議對65歲及以上老年人群、認知障礙科門診及病房首次就診患者進行常規營養風險篩查, 經篩查提示為高營養不良風險人群需要進一步完善營養評估. 推薦使用MNA和MNA-SF進行營養風險篩查和營養評估(Ⅱ級證據, B級推薦).
(2) 營養不良診斷與分級. 迄今為止, 尚無統一的營養不良診斷標準應用於AD患者. ESPEN指南提出,營養不良的診斷應基於BMI降低(<18.5 kg/m2), 或結合非自主型體重減輕與BMI或去脂體重指數(fat freemass index, FFMI)下降[103]. 體重減輕是指過去3個月內體重下降超過5%或超過習慣性體重的10%; BMI下降是指BMI<20 kg/m2(<70歲)或BMI<22 kg/m2(≥70歲);FFMI下降是指FFMI<15 kg/m2(女性)或<17 kg/m2(男 性). 全球領導人營養不良倡議(The Global LeadershipInitiative on Malnutrition, GLIM)提出, 營養不良的診斷至少要滿足一個表型標準(非自主型體重減輕、低體重指數和肌肉質量減少)和一個病因標準(食物攝取或吸收減少、炎症或疾病負擔)[104]. 營養不良的嚴重程度可根據體重減輕、BMI下降以及肌肉質量減少程度劃分(圖1).
推薦意見: 建議採用營養不良三級診斷方法, 即利用營養風險篩查工具選出高營養不良風險者; 其次,對這類患者進行營養評估, 以明確營養不良的型別與原因; 最後, 做出營養不良的診斷及嚴重程度分級, 為下一步制定營養治療計劃提供依據(Ⅰ級證據, A級推薦).
2.2 營養管理計劃
(1) 營養支援總體原則. 基於上述營養評估和診斷結果, 多學科醫生、護理人員以及照料者需要制定以患者為中心全面、合理的營養治療方案, 該方案應具備可以合理解釋、提供療效建議以及再評估的能力,即營養管理計劃. ESPEN共識提出, 營養管理計劃應包括以下幾方面: 滿足能量、液體和營養素需要量, 可衡量的營養目標(近期和長期), 營養治療型別和形式, 最合適營養治療通路和方法, 營養治療預計療程, 監測和評估引數, 出院計劃和家庭培訓[103]. 營養不良的規範治療應該遵循五階梯治療原則: 首先選擇營養教育, 然後依次向上晉級選擇口服營養補充(oral nutritionalsupplements, ONS)、全腸內營養(total enteral nutrition,TEN)、部分腸外營養(partial parenteral nutrition,PPN)、全腸外營養(total parenteral nutrition, TPN); 當下一階梯不能滿足60%目標能量需求3~5天時, 應該選擇上一階梯[105].
(2) AD患者不同階段的營養支援. 對於AD患者而言, 除上述普遍的營養護理, 還應該結合疾病特點, 在疾病不同階段尋找營養不良的原因, 給予相應的營養干預措施(表2)[22]. 這些干預措施一方面應彌補現有的營養不良, 同時應儘可能促進患者日常生活獨立.
(3) 重視對照料者的教育與培訓. 現階段, 我國大部分AD患者採用居家照料模式, 照料者以家庭成員和近親屬為主, 多為非正規護理人員. 配偶照料者往往年邁,
可能受到多種共病和功能殘疾的影響[106]. 研究顯示, 照料者具備營養相關任務的能力存在性別差異, 即男性照料者與AD患者的較低營養攝入有關[107]. 前文所述的照料者負擔與AD患者營養不良之間的惡性迴圈也提示教育和協助照料者管理患者飲食攝入和營養補充的重要性. 適宜的照料管理模式不僅可以延緩痴呆患者病情進展、改善其生活質量, 還可以減輕照料者負擔[108].對照料者或護理人員進行培訓和知識教育可能會對痴呆患者的營養行為和進食能力產生積極影響[109,110]. 例 如, 提供關於體重減輕、食慾減退和飲食技能喪失等處理方式, 培訓營養需求、用餐期間的交流策略以及適當的用餐任務技術等方面的資訊. 然而, 現階段關於照料者營養教育與培訓在AD患者病程中是否有明確作用的研究證據十分有限, 這可能與研究很難進行、訓練效果很難驗證以及評估受多種因素影響等有關.
(4) 營養治療的監測與評價. 對接受營養治療的患者進行療效監測與評價十分重要, 它可以檢查營養供應是否正在進行, 營養攝入或供應是否充足, 患者是否耐受, 以及預期目標和結果是否實現, 進而調整營養治療方案. 營養治療後的監測與評價是一系列流程,主要包括以下方面[91]. (ⅰ) 營養供給和攝入: 是否滿足計算出的液體、能量和蛋白質需求? (ⅱ) 體重和身體成分: 體重、BMI、FFMI是否按預期變化? (ⅲ) 生物化學指標: 現階段沒有最佳生物標誌物評價營養狀況,血漿白蛋白和甲狀腺素/前白蛋白濃度主要用於指示和監測分解代謝活性, 但受炎症干擾, 它們作為營養指標的有效性很低. (ⅳ) 功能: 單獨評價握力、椅子上升測試和步態速度, 或結合綜合功能評分, 如簡易機體功能評估法[111]. (ⅴ) 生活質量: 如健康指數量表-5D可作為營養狀況變化的非特異性粗略測量指標[112](圖1).
(5) 記錄. 營養管理計劃應該同醫療、飲食和護理一樣記錄至醫學電子病例中, 並給予出院後指導方案, 用於營養不良的三級診斷、營養治療方案與預期目標、治療的時間與療效評價以及負責跟進人員的說明, 以確保營養治療的持續性和隨訪[113]. 患者隨訪形式多樣, 可以面診、通話、影片甚至遠端交流.
推薦意見: 建議根據營養不良三級診斷結果制定以患者為中心、滿足患者和照料者雙重需求的營養管理計劃, 包括營養治療方案及對其監測、評價和記錄,以便隨時調整營養方案; 同時加強對照料者營養護理的教育和培訓(Ⅱ級證據, B級推薦).
3 營養支援與腦健康
3.1 單一營養素
(1) 碳水化合物. 營養素主要包括宏量營養素(即碳水化合物、蛋白質、脂肪)和微量營養素(維生素和礦物質)兩大類. 糖尿病是AD的可干預危險因素, 糖尿病患者出現不同程度認知功能障礙亦可見報道[114,115].胰島素管理海馬等區域的葡萄糖代謝, 並在直接調節AD早期記憶受損相關激酶中發揮關鍵作用[116]. 腦內胰島素抵抗可出現營養分配中樞調控作用受損、認知和情緒調節功能障礙以及大腦特異性神經退行性病變[117]. 正因AD與糖尿病和胰島素抵抗相關認知損害具有共同的分子和細胞特徵, 近年來, 有學者提出將AD視為“3型糖尿病”, 強調腦葡萄糖失調與AD發病機制間的聯絡[118,119]. 然而, 現階段仍無證據表明2型糖尿病與AD存在任何病理學層面有意義的聯絡, 二者是由胰島素抵抗和代謝異常所致相似因素引起的平行現象, 還是以某種方式與惡性病理生理迴圈相關的協同疾病仍需進一步探討. 同時, 也無研究證實補充或限制碳水化合物對AD患者臨床表現和預後的影響.
(2) 氨基酸和蛋白質. 蛋白質及其組成氨基酸(amino acid, AA)是飲食結構中不可缺少的組成部分, 對維持神經細胞功能和完整性至關重要. 蛋白質/AA可能透過影響與認知功能下降相關的危險因素髮揮重要作用[120]. 薈萃分析顯示, 3種支鏈AA(異亮氨酸、亮氨酸和纈氨酸)水平下降與AD相關認知障礙風險升高有關[121]. 隨機對照研究表明, 迴圈中谷氨醯胺及其代謝產物可預防認知功能下降, 在AD患者中起到保護作用[122]. 然而, 蛋白質/AA攝入在AD患者認知功能的作用機制不十分清楚, 關於所需蛋白質最佳攝入量的研究證據十分有限. 一項近1000名受試者的大規模調查顯示, 高膳食蛋白質攝入量與非語言學習、語言記憶以及MCI或AD風險減低呈正相關[123]; 但納入7個病例對照研究的薈萃分析表明, 與對照組相比, AD患者未見明顯的蛋白與能量攝入下降[124].
(3) 磷脂和脂肪酸. 脂肪酸與AD關係研究最為廣泛的即ω-3PUFAs, 它包括α-亞麻酸、硬脂酸、二十碳五烯酸(eicosapentaenoic acid, EPA)、二十二碳五烯酸(docosapentaenoic acid, DPA)和DHA. 研究表明,ω-3PUFAs攝入減少與AD相關認知障礙風險增加有關[125], 海洋來源的DHA與較低AD風險有關[126]. 然而,磷脂和脂肪酸在AD預防或治療方面的作用仍存在爭議. 研究顯示, 補充海藻DHA(2 g/d)並不能減緩輕至中度AD患者認知功能下降的速度[127]. 薈萃分析表明,ω-3PUFAs可能對認知障礙患者的某些認知域有保護作用, 但在健康人群或AD患者中沒有發現這種作用[128]. 另一項納入3個隨機對照研究的薈萃分析顯示,尚無令人信服的證據提示ω-3PUFAs補充劑治療輕至中度AD的有效性[129].
(4) 維生素. 補充B族維生素和其他抗氧化性維生素(如維生素A, C, E等)對輔助AD管理可能有積極作用. B族維生素影響AD疾病與其參與甲硫氨酸迴圈有關: 維生素B12參與同型半胱氨酸向甲硫氨酸的轉化,維生素B6和葉酸是這一反應的輔助因子[130]; 這些維生素的缺乏會導致體內同型半胱氨酸聚集, 從而降低S-腺苷甲硫氨酸水平, 後者作為一種甲基供體誘導DNA去甲基化, 進一步增加與AD發生相關基因的過度表達[69]. 橫斷面研究顯示, 血清同型半胱氨酸水平越高, 患AD的風險越高; 而高水平葉酸和維生素B12是預防認知障礙的保護因素[131]. 補充葉酸、維生素B12和B6可延緩MCI患者認知功能下降[132]. 研究表明, 低飲食攝入維生素A與痴呆風險增加有關[133], 長期攝入類胡蘿蔔素(維生素A前體)與晚年主觀認知功能呈正相關[134]. AD患者血液中維生素C和E水平與痴呆臨床表現存在相關性[135]. 隨機對照研究顯示, 單獨使用維生素E可以減緩輕至中度AD患者的認知功能下降[136], 食用富含維生素C水果對降低AD風險可能有益[137]. 歷時8年的InCHIANTI研究表明, 血清水平維生素D3降低與認知障礙風險增加有關[138].
相反地, 有證據表明, 補充維生素B12和葉酸並不能降低高同型半胱氨酸水平的老年人認知障礙發生率[139], 對該類患者的4個認知域(記憶力、注意力、資訊處理速度和執行功能)也無明顯有利影響[140]. 佇列研究顯示, 長期補充維生素E(400 IU/d)、硒(200 μg/d)和含硒維生素E(使用時間: 5.4±1.2年)均未起到預防痴呆的作用[141]. 給予2034名65歲以上女性1000 mg碳酸鈣和400 IU維生素D3並未降低痴呆或MCI發病率, 對整體或特定領域的認知功能也無明顯影響[142]. 前瞻性研究表明, 水果和蔬菜攝入對認知功能的影響可能因水果/蔬菜種類和認知域而異: 富含維生素C的果蔬以及補充維生素C和E可能提高語言記憶, 但富含β-胡蘿蔔素的果蔬可能與執行功能呈負相關[143]; 這提示研究單一維生素對認知功能的影響可能存在明顯偏倚. 小樣本隨機對照試驗顯示, α硫辛酸和ω-3FAs聯合應用在12個月內減緩了AD患者認知功能下降[144]; 剛完成的隨機對照試驗表明, 硫辛酸和魚油聯合使用18個月可以改善 A D 患者的日常生活能力和認知功能(NCT01058941); 提示多種營養素聯合補充可能對改善認知功能更有益.
(5) 礦物質. 人體所需礦物質需要透過飲食獲取,主要包括宏量元素(鈣、鎂、磷等)和微量元素(硒、銅、鐵、鋅、鈷等)兩大類. 有證據表明, AD的神經纖維纏結和老年斑內含有氧化還原活性的過渡金屬, 它們根據區域性微環境中細胞還原劑和氧化劑之間的平衡決定發揮促氧化或抗氧化活性作用[145,146]. 屍檢分析澱粉樣斑塊結果顯示, 銅、鐵和鋅沉積量分別是正常大腦水平的5.7、2.8和3.1倍, 提示AD與氧化還原金屬穩態失調之間的密切聯絡[147]. 薈萃分析表明, 血清銅水平與AD風險呈正相關, 血清鋅或鐵水平與AD風險呈負相關[148]. 給予AD患者鋅蛋氨酸口服治療3個月, 認知測試結果(ADAS-cog和MMSE)都比基線水平有所改善[149]. 前瞻性研究顯示, 鐵聚集與AD患者tau蛋白聚集和神經元丟失呈正相關, 尤其是在顳下回[150]. 但隨機對照結果表明, 口服銅補充劑對AD進展既無不利影響, 也無促進作用[151]. 口服補充鋅複方製劑並未改善AD患者任何認知測試結果(ADAS-Cog, MMSE,CDR), 且該前瞻性研究納入樣本量(42例)明顯大於前述陽性結果試驗(4例)[152]. 值得注意的是, 部分金屬元素生理需要量和中毒劑量相近易引起中毒, 這使得許多研究因為安全性問題提前終止. 明確的劑量、哪種形式的礦物質能到達腦內缺陷區域以達到臨床效果,以及補充或限制某種金屬及其化合物對AD病程及臨床症狀的影響均不明確.
推薦意見: 單一營養素的缺乏可能與AD認知功能改變有關, 但不推薦單獨補充或限制某種營養素及其化合物以改善患者認知功能或預防AD發生發展(Ⅱ級證據, B級推薦).
3.2 傳統中藥及其配方
傳統中藥含有多種有效成分, 可透過多途徑、多靶點促進海馬區神經再生髮揮抗痴呆作用, 符合AD多因素、多種病理機制的發病特點, 但單獨使用傳統中藥對AD的療效存在爭議[153]. 研究表明, 輕至中度痴呆患者(AD和血管性痴呆)服用銀杏葉提取物(Ginkgo biloba special extract, EGb 761)240 mg/d可改善認知功能、精神心理學表現和日常生活能力[154,155]; 但其他前瞻性研究顯示, 認知功能正常的老年人或MCI患者日二次服用120 mg EGb 761並不能降低AD相關認知障礙的發病率[156,157]. 亞洲臨床專家共識提出, EGb761對MCI、AD甚至血管性痴呆等有輔助治療作用,EGb 761聯合ChEIs和美金剛在改善AD和血管性痴呆患者的認知、行為和日常生活能力具有相同的證據級別(Ⅲ級證據, B級推薦)[158]. 給予APP/PS1-AD小鼠阿魏酸治療可以拮抗內皮素-1受體A(endothelin-1 receptor A, ETRA)介導的血管收縮作用, 預防海馬毛細血管密度和直徑減少, 並改善早期Aβ斑塊沉積和空間記憶障礙[159]. 多中心前瞻性隨機試驗表明, 補充Feru-guard(阿魏酸和白芷提取物)的MCI患者在24周時MMSE和ADAS-Cog評分均明顯提高[160]; 但另一項研究顯示,Feru-guard治療48周並未減少皮質Aβ的沉積, 也不能阻止腦萎縮加重和認知功能下降[161].
體內研究表明, 青蒿素透過抑制NF-κB活性和NALP3炎性小體啟用, 對AD病理具有保護作用, 提示靶向NF-κB和NALP3炎症小體活性對AD的潛在治療價值[162]. 其他中藥及其配方改善痴呆患者認知功能也可見報道[163]: 參麻益智方(人參、天麻、鬼箭羽、川芎)可以明顯提高血管性痴呆患者的MMSE評分[164];補陽還五湯(黃芪、赤芍、川芎、當歸、地龍、桃仁、紅花)顯著降低APP/PS1小鼠炎症因子的表達, 提高其學習和行為能力[165]. 儘管有一定的研究證據, 由於傳統中藥的複雜性, 其治療AD相關認知障礙的安全性和有效性仍需開展大量基礎和臨床研究進一步證實.
推薦意見: 傳統中藥及其配方如銀杏葉提取物(EGb 761)和Feru-guard可能改善MCI和AD患者的認知功能(Ⅲ級證據, B級推薦).
3.3 益生菌與益生元
腸道菌群生態平衡可促進最佳營養物質吸收和利用, 同時最佳營養狀況也可以調節腸道菌群的成分和多樣性, 減少疾病可能[166,167]. 國際益生菌和益生元科學協會共識稱, 一定數量的對機體/宿主健康產生有益影響的活性腸道微生物稱為益生菌; 透過選擇性刺激有益菌的生長與活性而對宿主產生有益影響的無活性營養物質則稱為益生元, 包括給予的益生菌菌株和定植微生物[168,169]. 動物實驗提示, 以益生菌(ProBiotic-4)為靶點的腸道菌群可能透過抑制TLR4和RIG-I介導的NF-κB訊號通路與炎症反應, 對“腸道菌群-腸-腦軸”功能紊亂和衰老相關認知障礙存在潛在治療價值[170].口服短雙歧桿菌A1株不僅可以逆轉AD小鼠模型交替行為受損, 縮短被動迴避實驗潛伏期, 還可以抑制Aβ誘導的海馬炎症和免疫反應基因的表達, 提示益生菌或益生元(如乳酸菌和雙歧桿菌)可能透過抑制神經炎症預防AD認知功能損害[171]. 隨機臨床試驗表明, 健康女性攝入益生菌發酵乳製品會影響控制情緒和感覺的大腦區域活性[172]; 給予AD患者益生菌乳200 mL/d, 12周後可以明顯提高MMSE評分和胰島素敏感性, 但對氧化應激和炎症相關生物標誌物和脂質水平沒有顯著影響[173]. 在美國, 已有多種益生菌製劑(如Vivomixx, Visbiome, DeSimone Formulation等)被視作膳食補充或醫療食品[174], 提示其潛在營養價值, 但益生菌和/或益生元能否預防AD發生發展以及改善臨床症狀仍缺乏實質性研究證據.
推薦意見: 單獨使用益生菌或益生元可能改善AD患者的認知功能(Ⅲ級證據, C級推薦).
3.4 整體膳食模式
無論是單一營養素、傳統中藥成分還是益生菌/元對改善AD患者認知功能或延緩病情進展的臨床研究證據均十分有限. 較單一營養素, 整體膳食模式因其含有多種營養素和食物以及彼此之間的協同作用, 在預防和延緩疾病發生髮展以及改善臨床症狀方面發揮更重要的作用[175]. 目前, 與AD相關認知障礙有關的膳食模式主要有MeDi、阻止高血壓飲食(Dietary Approach to Stop Hypertension, DASH)、MeDi-DASH飲食延緩神經退行性變(the Mediterranean-DASH diet Intervention for Neurodegenerative Delay, MIND)三種[176].
MeDi是以大量植物性食物(水果和蔬菜)為基礎,新增麵包、堅果等穀物, 適量橄欖油、少許魚肉以及適度飲酒為特點的健康膳食模式[177]. 薈萃分析顯示,MeDi依從性良好, 與MCI和痴呆, 尤其是降低AD發病風險有關[67]; 高度MeDi依從性不僅可以降低MCI和AD發病風險, 還能降低MCI進展為AD的風險[178]. 先後兩個西班牙多中心隨機對照試驗(PREDIMED研究)表明, MeDi中新增特級初榨橄欖油能提高高血管風險成年人的整體和額葉認知, 新增堅果能顯著改善記憶合成[179,180]. 基於5項隨機對照試驗和27項觀察性研究的系統綜述提示, 堅持MeDi與更好的認知表現有關,但二者之間缺乏明確的因果關係[181]. Neurology最新發表的橫斷面研究顯示, 高依從性MeDi是預防記憶力下降和大腦中顳部萎縮的保護因素, 且這些關聯可能由Aβ沉積和tau蛋白病變減少來解釋[182].
與MeDi相似, DASH膳食模式也強調了對植物性食物的高消耗量, 並限制了飽和脂肪酸、總脂肪、膽固醇和鈉的攝入. 但DASH對認知功能影響的研究證據相對有限, 目前主要集中在對心血管危險因素的預防[176,183]. 對923名平均年齡為81.4歲的老年人追蹤調查發現, DASH依從性最高的前1/3與AD低發病率之間存在積極聯絡[184]. 前瞻性研究表明, 高度堅持DASH與持續較高的認知功能水平相關[185]. 然而, 隨機對照試驗顯示, DASH加上體重管理能顯著改善執行功能、記憶力和學習能力, 僅DASH飲食並沒有觀察到這種效果[186]. 縱向佇列研究表明, 以MeDi或DASH飲食評分為特徵的膳食模式與老年婦女的認知功能下降無關, 堅持健康的膳食模式並不能改變高血壓婦女認知功能下降的風險[187]. 造成上述結論不一致的原因可能與納入人群年齡和性別差異較大有關, 需要進一步開展前瞻性干預試驗和真實世界研究以明確DASH在AD人群中的作用.
MIND膳食模式結合MeDi和DASH兩種膳食模式中已被證明具有神經保護作用的飲食成分, 強調天然植物性食物, 限制動物性食物和高飽和脂肪食物的攝入, 並規定了漿果和綠葉蔬菜的消耗[188]. 縱向佇列研究顯示, MIND膳食模式與降低MCI, AD以及血管性痴呆的發病率有關[189]. 同一團隊的兩項縱向研究表明,高度堅持MeDi, DASH和MIND這三種膳食模式均可以降低AD發病風險, 但中度堅持MIND也可以降低AD發病風險(35%), 並且MIND還可以顯著減緩衰老相關認知功能下降[190,191]. 薈萃分析提示, 上述三種膳食模式的依從性越高, 認知功能下降和AD患病風險越低[192], 且這種關聯在MIND飲食中最強[193]. 其他健康膳食模式, 如低血糖飲食、限制熱量飲食、間歇性禁食(生酮飲食)以及統計資料生成的飲食方法(健康飲食法)等對降低AD相關認知功能障礙和病理改變亦見報道, 但研究證據較少且結論不完全一致[194~196].
雖然MeDi和MIND膳食模式對預防和延緩AD相關認知障礙有一定的保護作用, 但研究證據多集中在歐洲和西方國家, 這兩種整體膳食模式是否適用於中國人群仍需進一步證實. 近日, 中國營養學會根據國務院釋出的《國民營養計劃(2017-2030年)》中的指導思想, 在《食物與健康-科學證據共識(2016版)》的基礎上[197], 彙集了近5年國內外有關膳食指南的工作進展、膳食與健康研究的新證據, 以我國居民膳食與營養健康現況及問題為導向, 修訂釋出了《中國居民膳食指南科學研究報告(2021)》. 《報告》指出中國居民應遵循“五穀為養, 五畜為益, 五菜為充, 五果為助”的平衡膳食原則, 提倡食物來源的多樣性, 提高全穀物、深色蔬菜、新鮮水果以及富含優質蛋白的豆製品的消費, 增加富含多不飽和脂肪酸的水產品和低脂奶製品的攝入, 保證膳食能量來源和營養素充足、比例平衡, 控制糖和含糖食品消費, 進一步減少油、鹽和高度精細化加工食品攝入等具有中國特色、符合中國國情的營養指導措施[198].
推薦意見: 高度依從MeDi或MIND膳食模式, 遵 循“五穀為養, 五畜為益, 五菜為充, 五果為助”的平衡膳食原則, 有利於降低AD患病風險並延緩認知功能下降(Ⅰ級證據, B級推薦).
3.5 口服營養補充
補充或限制單一營養素對AD疾病進展以及症狀改善缺乏有效性證據, 而高度依從MeDi和MIND整體和平衡膳食模式可以降低AD患病風險並延緩認知功能下降, 這強調了營養物質之間及其與食物間的協同作用在改善認知功能中的重要性. 除正常食物以外,經口攝入FSMP以補充日常飲食和能量的不足, 在醫學上稱為ONS. 它是一種口味多樣、劑型不一的富含宏量營養素(蛋白質、碳水化合物、脂肪酸)和微量營養素(維生素、礦物質)的複合營養產品, 按照“3+3”模式實施, 即在三頓正餐後加服的FSMP[199]. ONS在飲食基礎上提供額外的營養和能量供給, 當額外能量供給達到400~600 kcal/d時, 有助於改善機體營養狀況.隨機對照試驗表明, ONS比單純的飲食建議能更有效地改善療養院中營養不良居民的生活質量和營養攝入[200], 提示了營養補充的整體改善作用. 20世紀70年代以來, 商品化的FSMP逐漸應用於臨床, 與AD相關的ONS製劑如Souvenaid、生酮飲品等亦可見報道(表3),其中研究證據最充分的是Souvenaid.
Souvenaid是一種基於MeDi飲食模式, 含有神經細胞膜和突觸形成與功能所必需的前體和輔助因子(長 鏈ω-3脂肪酸、尿苷、膽鹼、B族維生素、維生素C、維生素E和硒)的日一次複合飲品[58]. 相關臨床試驗經過近10年的不斷更新: 2010和2012年分別發表的隨機對照試驗顯示, 補充Souvenaid 12周和24周均可以提高未用藥輕度AD患者的記憶功能(尤其是延遲言語回憶), 且耐受性良好; 腦電圖結果提示Souvenaid對大腦功能連線有影響, 支援營養補充可改變突觸活性的基本假設[51,201]. 2013年, 隨機雙盲對照試驗表明, 在24周內補充Souvenaid並不能減緩輕至中度AD患者的認知功能下降, 但其與抗痴呆藥物聯合應用無藥物-營養不良反應[202], 提示Souvenaid改善認知的益處可能主要體現在AD早期階段, 而非中晚期. 2017年, The LancetNeurology發表的歷時24個月的多中心隨機對照試驗表明, 臨床前期AD患者使用Souvenaid兩年後認知功能下降減少45%, MRI顯示海馬萎縮減少26%, 但神經心理測驗無顯著改善[203]; 將營養干預時間延長至36個 月, 2020公佈的臨床研究成果顯示, 補充Souvenaid不僅明顯延緩了認知功能下降和腦萎縮, 神經心理測驗評分也明顯改善, 提示長期補充Souvenaid可能獲益更大[204]. ESPEN對癌症相關營養不良提出的建議中強調, 長期甚至終身營養有助於改善患者整體狀況甚至延長生存時間[205]. 營養補充需要持續一段時間才能體現出治療效果, 持續時間因人而異, 但至少1個月以確定總攝入量能否滿足日常機體需求, 這些證據都強調了長期、持續營養補充的重要性. 最新一項真實世界研究表明, 與ChEIs單藥或無藥物治療相比, Souvenaid聯合ChEIs以及Souvenaid單獨應用於輕度AD患者明顯改善CDR評分, 且聯合應用療效更佳, 進一步提示營養補充與抗痴呆藥物的潛在協同作用[206]. 結合現有研究證據, 最新專家共識提出, 對於早期AD和AD源性MCI患者應考慮選擇Souvenaid, 暫不推薦中晚期AD患者使用以改善認知功能[207].
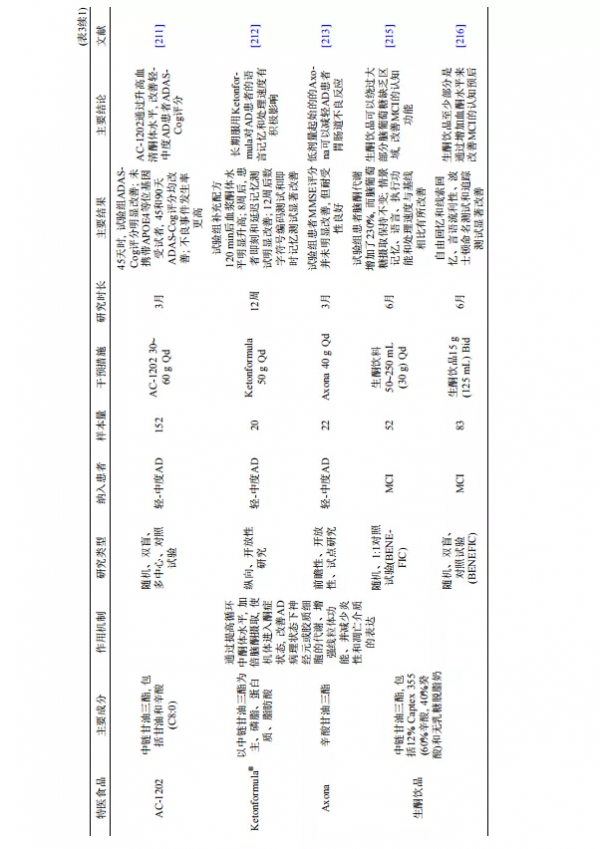
生酮飲食是一種高脂肪、低碳水化合物的飲食模式, 具有類似禁食的效果, 觸發機體從葡萄糖代謝系統性轉變為脂肪酸代謝; 產生的酮體不僅對衰老細胞有神經保護作用, 還可以增強線粒體功能並減少炎性和凋亡介質的表達[208]. 因此, 生酮飲食作為改善AD相關認知功能障礙的潛在治療方式逐漸引起關注[209,210]. 前瞻性隨機試驗表明, AC-1202(口服生酮化合物)可以透過升高AD患者的血清酮體水平來改善其45和90天的ADAS-Cog評分, 尤其是對APOE-ε4基因陰性的受試者[211]. 給予20名輕至中度AD患者以中鏈甘油三酯(medium-chain triglyceride, MCT)為基礎的生酮飲食配方(Ketonformula)12周後, 患者的詞語記憶和處理速度明顯改善[212]; 但另一項前瞻性開放試驗顯示, 補 充Axona(含MCT的FSMP)3個月, 輕至中度AD患者的認知功能並未改善[213]. AD患者補充酮單酯(口服強效生酮劑)20個月, 其認知功能、日常生活活動、心境與情緒以及自我照顧等方面均有明顯改善, 且耐受性良好[214]. 最新兩項隨機對照試驗表明, MCI患者補充含MCT的生酮飲品6個月後, 情景記憶、語言、執行功能和處理速度等認知功能明顯改善, 至少部分是透過增加血酮水平起作用[215,216]. 總體而言, 生酮飲食/飲品在改善AD患者認知功能的有效性證據仍侷限在個案研究和小型試點研究, 採用的FSMP配方和攝入劑量與頻率不十分一致, 使得酮症的程度和持續時間具有較大異質性, 結果不十分可靠. 期待更多幹預性隨機對照試驗探討生酮飲食/飲品對AD患者認知功能的影響(NCT03860792).
其他ONS相關臨床研究證據相對較少. 2004年報道的關於一種富含微量營養素(維生素E、維生素C、維生素B12、葉酸、鋅、銅、錳和精氨酸)的ONS產品的臨床研究未見其在預防體重下降和輕度AD疾病進展方面的作用[217]. 西班牙一項關於基於凍幹食品(Vegenat-med)全營養配方飲食的隨機對照試驗表明, 接受飲食建議的晚期AD患者體重增加, 但神經精神功能(認知、抑鬱)和不良事件(住院、死亡)未見明顯改善[218]. 另一種由葉酸、維生素B12、維生素E、S-腺苷甲硫氨酸、N-乙醯半胱氨酸、乙醯-L-肉鹼組成的營養製劑(NF), 旨在透過糾正葉酸缺乏、降低同型半胱氨酸水平和減少氧化應激來實現神經保護作用[219]. 一項多中心Ⅱ期臨床試驗表明, 補充NF 3~6個月可以維持或改善AD患者認知功能和情緒/行為異常[220]; 將觀察時間延長至1年發現, 接受NF補充的24名AD受試者在12個月內仍維持基線認知功能和精神/行為表現[221].
推薦意見: 補充合適劑量的ONS可以改善AD相關認知障礙患者的營養狀況和生活質量(Ⅰ級證據, B級推薦). 早期AD和AD源性MCI患者可考慮儘早選擇Souvenaid補充, 不推薦中重度或晚期AD患者使用任何ONS用以改善認知症狀(Ⅱ級證據, B級推薦).
3.6 腸內/腸外營養
腸內營養(enteral nutrition, EN)指經消化道途徑置入導管或造口給予腸內營養劑的營養治療方法.ESPEN將EN配方製劑特別侷限於FSMP管飼, 食物勻漿管飼不屬於該類, 且前文將ONS單獨提出, 因此, 這裡的EN特指腸內FSMP管飼. 腸內管飼營養包括TEN、部分EN和家庭EN, 其型別和管飼途徑各有特殊的益處和風險[22]. 晚期或終末期痴呆患者因吞嚥困難、終日臥床等原因無法主動進食是照料者和臨床醫生常要面臨的重大挑戰. 目前, 腸內管飼營養在AD患者中的應用仍存在爭議, 倫理問題也使得評估其潛在利弊的前瞻性臨床試驗開展受限. 既往研究證據未顯示晚期痴呆患者因吞嚥困難接受EN後長期生存率得到改善[222,223]. 系統綜述表明, 接受EN痴呆患者的死亡率取決於疾病分期和長期預後等可比性條件; EN對患者生活質量的影響尚不清楚, 並不建議在臨終關懷中盲目使用[224]. 多中心回顧性研究表明, 腸內管飼營養可延長痴呆患者生存期[225], 該團隊隨後開展管飼前後肺炎發病率的研究發現, EN可以減少重度痴呆患者肺炎和抗生素使用的頻率[226]. 這些結果並不代表重度痴呆患者應該常規應用EN, 需要結合患者預期壽命、生活質量以及護理費用等綜合評估.
腸外營養(parenteral nutrition, PN)是透過靜脈途徑給予患者包括氨基酸、脂肪乳、碳水化合物、電解質、維生素以及注射用水在內的不同營養素組合. 根據痴呆患者對EN耐受度以及營養供應情況, 選擇PPN或TPN支援方式[227]. 需要PN支援的患者常處於AD終末期, 現階段PN在臨終關懷中的應用亦存在爭議. 美國大多數腫瘤科醫生不推薦PN用於臨終關懷, 因為它不僅會增加並延長病人的痛苦, 還可能導致嚴重併發症(如血流感染、肝衰竭)[227,228]. Cochrane回顧發現,只有5個前瞻性非對照姑息治療患者使用藥物輔助營養的實踐, 尚無足夠質量的前瞻性隨機對照試驗對AD相關認知障礙患者晚期或終末期是否需要應用PN提出任何建議[229].
推薦意見: 晚期或終末期AD患者使用腸內管飼或腸外營養支援需要綜合考慮宗教信仰、病人生活質量、預期壽命以及家庭照料或機構工作人員的負擔等情況個體化使用(Ⅲ級證據, B級推薦).
4 結論與展望
鑑於目前已知藥物對AD患者預防和治療作用的侷限性, 營養干預的納入有效深化了AD的全面管理內涵. 本共識是國內首次對AD腦健康營養干預管理策略提出指導建議, 經專家組多次討論、反覆修改、協商一致提出全部推薦意見(表4). 本共識強調營養干預應以“早期、協同、整體、長期”為原則, 重視膳食營養等生活方式調節作為AD相關認知障礙的“零級預防”策略以及在改善臨床症狀和整體預後的重要地位, 有助於提升臨床醫生對AD患者各階段營養風險篩查與評估、診斷與治療等綜合規範管理水平. 囿於營養與AD相關認知障礙的臨床研究證據不足, 期待本共識的推薦意見可以推動更多的國際多中心前瞻性試驗及真實世界研究開展, 為今後共識或指南的修訂提供更多證據, 從而不斷提高我國AD相關認知障礙的綜合防治水平.
委員會成員
執筆: 徐俊(首都醫科大學附屬北京天壇醫院).
共識撰寫秘書組(按姓氏拼音為序): 杜振蘭(解放軍總醫院第七醫學中心)、姜季委(首都醫科大學附屬北京天壇醫院)、賈平平(首都醫科大學附屬北京世紀壇醫院).
共識撰寫組成員(按姓氏拼音為序): 蔡靜(貴州中醫藥大學第一附屬醫院)、陳勁龍(廣州市第一人民醫院)、陳玲(中山大學附屬第一醫院)、陳志剛(北京中醫藥大學東方醫院)、杜忠禮(國家衛生健康委臨床檢驗中心)、李陽(山西醫科大學第一醫院)、石漢平(首都醫科大學附屬北京世紀壇醫院)、沈偉(華中科技大學同濟醫學院附屬普愛醫院)、湯薈冬(上海交通大學醫學院附屬瑞金醫院)、譚小林(重慶市精神衛生中心)、徐德恩(南京醫科大學附屬無錫二院)、徐俊(首都醫科大學附屬北京天壇醫院)、徐嚴明(四川大學華西醫院)、楊健(首都醫科大學附屬北京安定醫院)、楊文明(安徽中醫藥大學第一附屬醫院)、張慶娥(首都醫科大學附屬北京安定醫院)、張振濤(武漢大學人民醫院).
中華醫學會腸外腸內營養學分會腦健康營養協作組成員(按姓氏拼音為序): 陳勁龍(廣州市第一人民醫院)、陳蘭蘭(江蘇省蘇北人民醫院)、陳啟華(中南大學湘雅二醫院)、陳廷濤(南昌大學)、陳小武(深圳大學總醫院)、杜忠禮(國家衛生健康委臨床檢驗中心)、杜振蘭(解放軍總醫院第七醫學中心)、方樂(吉林大學中日聯誼醫院)、高利增(中國科學院生物物理研究所)、葛宇松(大連醫科大學附屬第二醫院)、侯曉霖(寧夏醫科大學總醫院)、黃天文(福建醫科大學附屬協和醫院)、賀電(貴州醫科大學附屬醫院)、匡華(江南大學食品學院)、羅紅波(遵義醫科大學第五附屬醫院)、劉華巖(中國醫科大學附屬第一醫院)、劉萍(浙江大學醫學院附屬第一醫院)、李陽(山西醫科大學第一醫院)、皮榮標(中山大學)、時建銓(南京市第一醫院)、孫麗華(內蒙古醫科大學附屬醫院)、孫遜沙(中山大學附屬第一醫院)、湯薈冬(上海交通大學醫學院附屬瑞金醫院)、湯其強(中國科學技術大學附屬第一醫院)、唐震宇(南昌大學第二附屬醫院)、徐德恩(無錫市第二人民醫院)、徐俊(首都醫科大學附屬北京天壇醫院)、徐嚴明(四川大學華西醫院)、楊健(首都醫科大學附屬北京安定醫院)、燕楠(中國科學院深圳先進技術研究院)、張才溢(徐州醫科大學附屬醫院)、趙敬堃(哈爾濱醫科大學附屬第一醫院)、左年明(中國科學院自動化研究所)、張元(北京聯合大學生物化學工程學院)、趙延欣(同濟大學附屬第十人民醫院)、張振昶(蘭州大學第二醫院)、張振濤(武漢大學人民醫院).