在過去的幾十年裡,手術和輔助化療確實提高了結腸癌患者的5年總生存(OS)率[1],但仍有約36%的III期結腸癌患者會出現癌症復發[2,3]。為了降低癌症復發和死亡率,改善患者預後,迫切需要開發新的預測模型。
目前,預測III期結腸癌患者生存結局的模型依賴於臨床和病理特徵指標,如年齡、性別、淋巴結陽性和T分期等[4,5]。近來,已有研究發現飲食和生活方式可能顯著影響結腸癌復發和死亡風險[6,7],那麼將二者新增到預測模型是否會提高模型的準確性呢?
近日,由耶魯公共衛生學院Charles S. Fuchs領銜的研究團隊在Journal of Clinical Oncology期刊上發表重要研究成果[8]。
他們發現,將飲食和生活方式因素新增到臨床和病理特徵預測模型中,顯著提高了預測模型的效能,即無病生存(DFS)預測模型一致性指數從0.64提高到0.69,OS預測模型從0.67提高到0.71;另外,將有利的飲食和生活方式因素新增到模型中,所有患者5年DFS率和OS率均得到顯著改善。
這一結果有利於臨床醫生為患者進行個性化的生存預測,促使患者改變飲食和生活方式,以降低癌症復發和死亡風險。
▲ 論文首頁截圖
Fuchs團隊這項研究涉及的1024例III期結腸癌患者,均來自於腫瘤學臨床試驗聯盟89803研究,所有患者都接受藥物輔助治療,並收集其臨床特徵資訊。另外,在接受輔助治療期間和完成治療後的6-8個月,均透過問卷形式收集患者人口統計學、藥物使用、家族史、飲食和生活方式等資訊。
在中位隨訪長達7.3年的時間裡,Fuchs團隊觀察到311例死亡、350例復發和394例為DFS狀態。這些患者的中位年齡為60歲,其中,43.8%為女性,88.8%為白人。
為了構建更精確的預測模型,研究人員結合已有研究發現,將以下飲食和生活方式因素納入模型,包括咖啡、堅果、黑肉魚、加糖飲料、精製穀物、富含番茄紅素的蔬菜、阿司匹林和COX-2抑制劑的使用、體力活動、預測的25-羥基維生素D得分、吸菸、以及BMI[9-11]。
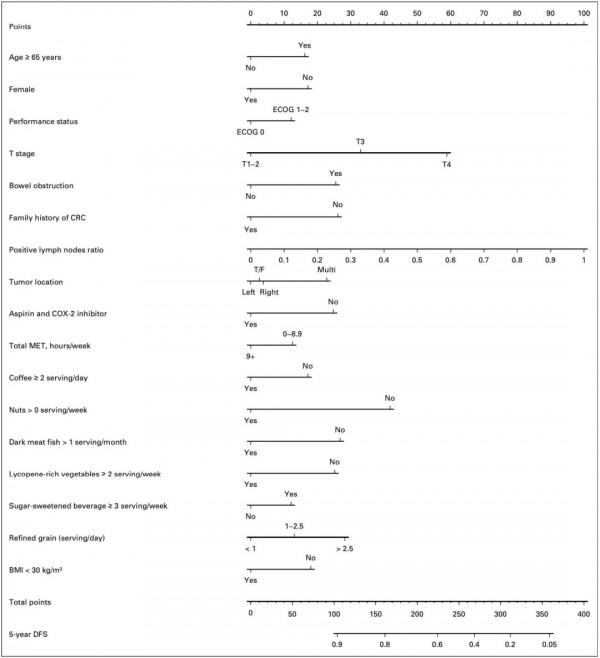
研究人員發現,阿司匹林和COX-2抑制劑的使用、咖啡、堅果、肉色深的魚、富含番茄紅素的蔬菜,以及BMI均與DFS顯著相關;而體力活動、堅果、肉色深的魚及BMI均與OS顯著相關。
▲ DFS預測模型列線圖
接下來,Fuchs團隊評估了預測模型的效能,他們發現將飲食和生活方式因素新增到預測模型後,DFS預測模型的一致性指數從0.64(95%CI,0.62-0.67)提高到0.69(95%CI,0.67-0.72),OS預測模型從0.67(95%CI,0.64-0.70)提高到0.71(95%CI,0.69-0.75),兩種模型的效能均得到顯著改善。
此外,Fuchs團隊還透過另一項輔助化療試驗(CALGB/SWOG 80702,包括2526名III期結腸癌患者)對兩個模型做了進一步的外部驗證,均具有良好的識別和校準效能。
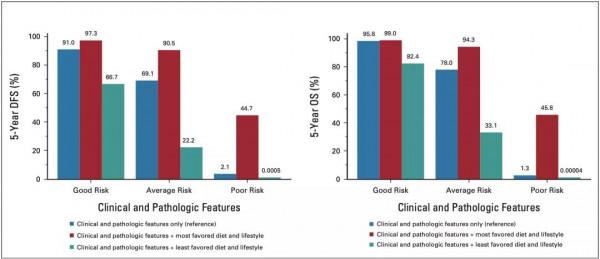
緊接著,Fuchs團隊對患者五年預測DFS率和OS率、以及癌症復發和死亡RR進行分析。根據臨床和病理特徵資料,他們先將患者分為良好風險、平均風險、以及不良風險三類。結果顯示,與僅包含臨床和病理特徵相比較,新增有利的飲食和生活方式因素將顯著改善DFS率。其中,良好風險患者增加6.3%,平均風險患者增加21.4%,不良風險患者增加42.6%。
相比之下,新增不利的飲食和生活方式因素,將使良好風險患者DFS率降低24.3%,平均風險患者降低46.9%,不良風險患者降低2.1%,結腸癌復發或死亡RR增加至3.69(95% CI,2.71-5.12);患者五年預測OS率與DFS率同理,但RR幅度較大。
以上結果表明維持有利的飲食和生活方式,可以提高患者生存率、降低癌症復發和死亡風險。
▲ 具有不同臨床、病理、飲食和生活方式特徵患者的五年預測DFS率和OS率
值得注意的是,本研究中的預測模型未考慮預後生物標誌物,這有待於進一步研究。其次,預測模型未反映出結腸癌治療的最新突破,可能低估了生存率。另外,本研究人群僅為III期結腸癌患者,新增飲食和生活方式因素的預測模型是否適用於其他階段結腸癌人群,有必要對其進行進一步評估。
綜上所述,基於飲食和生活方式因素的預測模型,可以更有效預測III期結腸癌患者的癌症復發和死亡風險。
參考文獻
[1] Akagi T, Inomata M. Essential advances in surgical and adjuvant therapies for colorectal cancer 2018-2019. Ann Gastroenterol Surg. 2020;4(1):39-46. Published 2020 Jan 28. doi:10.1002/ags3.12307
[2] Böckelman C, Engelmann BE, Kaprio T, Hansen TF, Glimelius B. Risk of recurrence in patients with colon cancer stage II and III: a systematic review and meta-analysis of recent literature. Acta Oncol. 2015;54(1):5-16. doi:10.3109/0284186X.2014.975839
[3] Osterman E, Glimelius B. Recurrence Risk After Up-to-Date Colon Cancer Staging, Surgery, and Pathology: Analysis of the Entire Swedish Population [published correction appears in Dis Colon Rectum. 2020 Mar;63(3):e36-e37]. Dis Colon Rectum. 2018;61(9):1016-1025. doi:10.1097/DCR.0000000000001158
[4] Valentini V, van Stiphout RG, Lammering G, et al. Nomograms for predicting local recurrence, distant metastases, and overall survival for patients with locally advanced rectal cancer on the basis of European randomized clinical trials. J Clin Oncol. 2011;29(23):3163-3172. doi:10.1200/JCO.2010.33.1595
[5] He Y, Ong Y, Li X, et al. Performance of prediction models on survival outcomes of colorectal cancer with surgical resection: A systematic review and meta-analysis. Surg Oncol. 2019;29:196-202. doi:10.1016/j.suronc.2019.05.014
[6] Rock CL, Doyle C, Demark-Wahnefried W, et al. Nutrition and physical activity guidelines for cancer survivors [published correction appears in CA Cancer J Clin. 2013 May;63(3):215]. CA Cancer J Clin. 2012;62(4):243-274. doi:10.3322/caac.21142
[7] Van Blarigan EL, Meyerhardt JA. Role of physical activity and diet after colorectal cancer diagnosis. J Clin Oncol. 2015;33(16):1825-1834. doi:10.1200/JCO.2014.59.7799
[8] Cheng E, Ou FS, Ma C, et al. Diet- and Lifestyle-Based Prediction Models to Estimate Cancer Recurrence and Death in Patients With Stage III Colon Cancer (CALGB 89803/Alliance) [published online ahead of print, 2022 Jan 7]. J Clin Oncol. 2022;JCO2101784. doi:10.1200/JCO.21.01784
[9] Guercio BJ, Sato K, Niedzwiecki D, et al. Coffee Intake, Recurrence, and Mortality in Stage III Colon Cancer: Results From CALGB 89803 (Alliance). J Clin Oncol. 2015;33(31):3598-3607. doi:10.1200/JCO.2015.61.5062
[10] Fadelu T, Zhang S, Niedzwiecki D, et al. Nut Consumption and Survival in Patients With Stage III Colon Cancer: Results From CALGB 89803 (Alliance). J Clin Oncol. 2018;36(11):1112-1120. doi:10.1200/JCO.2017.75.5413
[11] Ng K, Meyerhardt JA, Chan AT, et al. Aspirin and COX-2 inhibitor use in patients with stage III colon cancer. J Natl Cancer Inst. 2014;107(1):345. Published 2014 Nov 27. doi:10.1093/jnci/dju345