本文來自微信公眾號:X-MOLNews
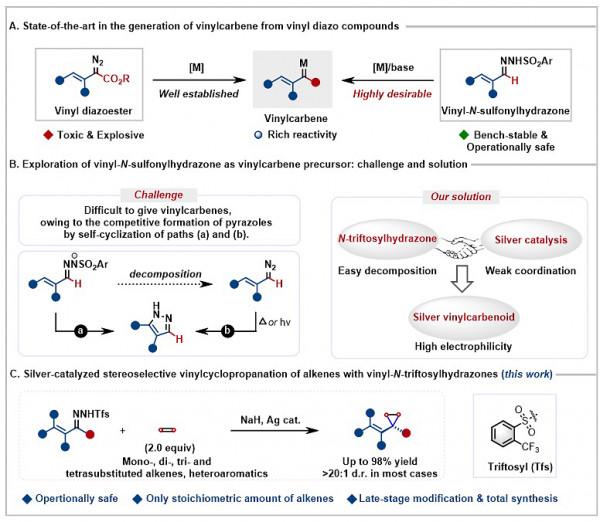
烯基磺醯腙作為一類理想的烯基卡賓前體,具有容易製備,結構多樣性,操作簡單安全的優點。但其存在分解生成的烯基-N-磺醯腙陰離子中間體或原位生成的烯基重氮甲烷容易進行自環化成吡唑的難題,始終未能得到有效解決。因此,如何利用烯基磺醯腙作為烯基卡賓前體是一個亟待解決的問題。近日,東北師範大學畢錫和教授(點選檢視介紹)課題組在該方向取得了重要進展,成功解決了這一長期存在的難題:作者設計合成了烯基-N-鄰三氟甲基苯磺醯腙,該類磺醯腙具有易於分解的優勢,透過鹼分解再與銀催化劑的弱作用形成烯基銀卡賓,成功避免了吡唑副產物的生成,實現了與各種烯烴的高立體選擇性烯基環丙烷化反應(圖1)。這一方法成功用於克級合成、天然產物/藥物結構後修飾以及生物活性分子全合成。全面的DFT計算分析揭示:烯基-N-三氟甲基苯磺醯腙的易分解性與銀催化劑的弱作用性是課題成功的關鍵因素。
圖1. 烯基-N-鄰三氟甲基苯磺醯腙作為乙烯基卡賓源與烯烴[2+1]環丙烷化反應
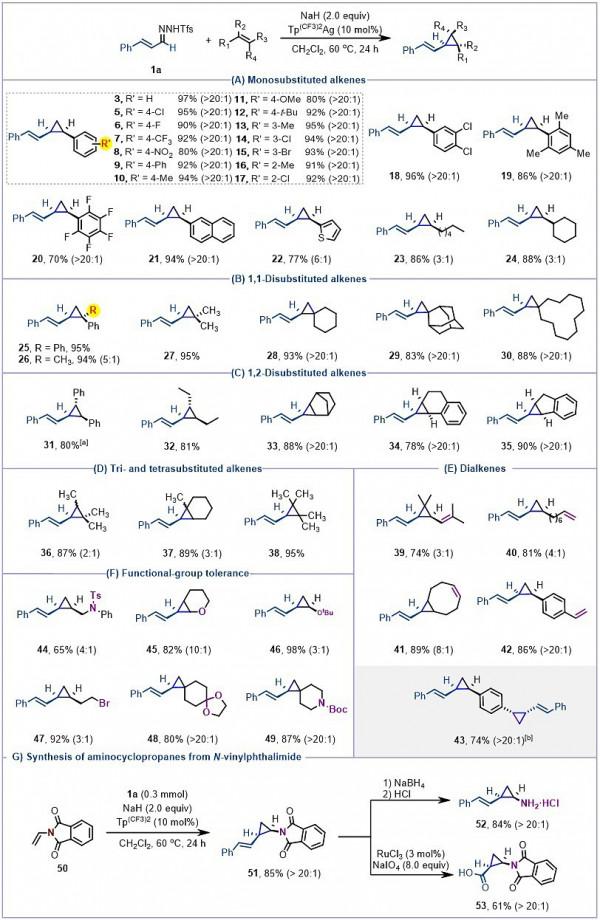
反應的底物適用範圍非常寬泛,單取代、雙取代芳基或者烷基烯烴均能以較高的產率生成順式立體選擇性烯基環丙烷產物(圖2)。利用該策略,高效高產率地得到了兼具環丙烷單元和全季碳中心螺環的烯基環丙烷衍生物,反應過程中官能團耐受性高,如:磺醯胺、醚、鹵化物、縮醛、胺等基團。甚至更具挑戰性的、大位阻的1,2-二芳基(烷基)乙烯、三取代和四取代烯烴也能得到預期的多取代烯基環丙烷化產物。該方案還被成功用於合成氨基取代乙烯基環丙烷,它是選擇性5-HT1A受體激動劑的關鍵結構單元。
圖2. 烯烴的底物範圍
此外,作者還探討了各種α,β-不飽和醛衍生的烯基-N-三氟甲基苯磺醯腙,結果均得到了多取代或功能化的高立體選擇性取代的乙烯基環丙烷。其中,(E,E)-二烯基-N-三氟甲基苯磺醯腙得到了具有藥物關鍵結構單元的1,3-丁二烯環丙烷產物。作者還成功的將這一策略應用於α,β-不飽和酮衍生的乙烯基-N-三氟甲基苯磺醯腙,構建含有季碳中心的烯基環丙烷,其中對於含酯基乙烯基環丙烷的合成與之前Davies報道的使用苯乙烯基重氮乙酸酯合成產物的方法相比,該策略具有操作簡單、產率高和立體選擇性好等優點。作者還透過兩種策略(雙烯和烯基磺醯腙或雙烯基磺醯腙和單烯)進行低聚環丙烷化的構建,高選擇性和高產率地得到了雙烯基環丙烷,在聚合應用中展現出潛力(圖3)。
圖3. 烯基-N-鄰三氟甲基苯磺醯腙的底物範圍
同時,作者還發現烯基-N-鄰三氟甲基苯磺醯腙在銀催化下可與雜芳烴發生失芳香性的烯基環丙烷化反應,如:苯並呋喃、呋喃、苯並噻吩、吲哚等均可參與反應,立體選擇性地生成相應的並環產物(圖4)。
圖4. 脫芳基乙烯基環丙烷化反應
銀催化的烯基環丙烷化反應能夠在克級規模進行,展現了這一方法的實用性和進一步大規模應用的可能性。同時,作者也將其用於藥物/天然產物的結構後修飾,例如:蛇床子素、α-蒎烯、香豆素、非諾貝特、雌酚酮等順式乙烯基環丙烷衍生化的產物,而且實現了含有苯並呋喃的生物活性分子(如:佛手柑內酯、補骨脂素和花椒毒素)的脫芳基環丙烷化反應。進一步,直接應用於天然存在的α,β-不飽和醛(如:紫蘇醛、巴豆醛、反式-4-氧基-2-丁烯酸乙酯、氟伐他汀),其衍生的乙烯基-N-三氟甲基苯磺醯腙也順利地與苯乙烯反應生成相應的烯基環丙烷產物(圖5)。
圖5. 克級反應和複雜天然產物的後修飾
作者進一步將該方法用於合成複雜藥物和天然產物(圖6),例如:以簡短的三步反應便高收率合成了具有抗炎和抗癌活性的視黃素類X受體(RXR)51%(AGN194204)和35%(AGN194277),然而,之前的方法從相同的酮底物出發,需要進行七步操作,總收率為14.9%(AGN 194204)和2.6%(AGN 194277);實現了乳酸桿菌酸(一種天然順式環丙烷脂肪酸)中間體的高產率、高立體選擇性合成(92%收率,之前方法為48%);從馬鞭草烯酮衍生的N-三氟甲基苯磺醯腙實現了分子內的烯基環丙烷化,一步高收率得到了天然產物Bolivianine(一種結構複雜的二酯萜類化合物)的關鍵中間體(1步95%),而文獻報道的方法需要2步反應,65%的產率。
圖6. 銀催化乙烯基環丙烷化反應在縮短生物活性分子合成中的應用
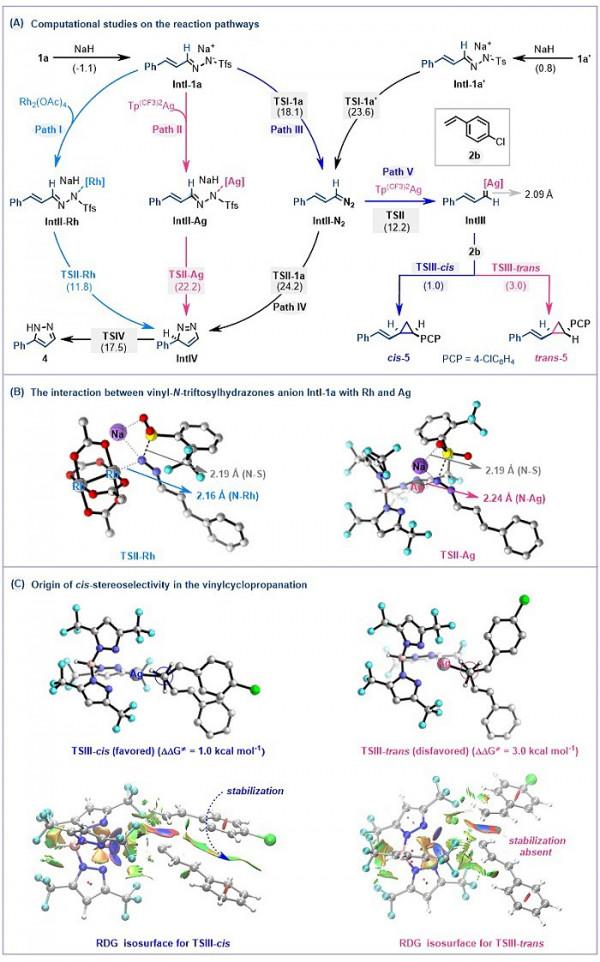
機理研究表明,乙烯基-N-鄰三氟甲基苯磺醯腙分解釋放乙烯基重氮甲烷的能壘比乙烯基-N-對甲苯磺醯腙低5.5 kcal mol-1,這主要是鄰位三氟甲基的吸電子效應和空間位阻效應導致的(圖7A)。接下來,在比較銠與銀催化介導下乙烯基-N-磺醯腙陰離子自環化為吡唑和無過渡金屬條件下分解釋放乙烯基重氮甲烷的能壘時,作者發現,在銠催化下優先經歷自環化形成吡唑,而銀催化有利於生成烯基重氮甲烷。這主要是由於銀的配位效應相對於銠較弱導致的,透過對TSII Ag和TSII Rh的過渡態分析進一步證實了這一點,其中Ag-N距離(2.24 Å)比Rh-N距離(2.16 Å)相對長一些(圖7B)。隨後,作者還發現烯基重氮甲烷形成乙烯基銀卡賓比環化形成吡唑的自由能壘低12.0 kcal mol-1,其中具有單鍵鍵長性質的Ag-C鍵(2.09 Å)表明了銀對乙烯基卡賓較弱的穩定性,從而導致了乙烯基銀卡賓相對較高的親電性。最後,該DFT計算結果揭示了乙烯基銀卡賓環丙烷化的非同步協同機制,其中順式(1.0 kcal mol-1)和反式(3.0 kcal mol-1)異構體之間的能壘差為2 kcal mol-1,表明順式立體選擇性占主導地位,根據過渡態理論計算的kcis/ktrans比率(20.5:1)很好的證明了這一點,同時,約化密度梯度分析(RDG)顯示,在順式過渡態TSIII中存在非共價 π-π 相互作用,而TSIII反式結構中不存在這種相互作用(圖7C)。作者透過計算,得到了與實驗觀察到的順式立體選擇性的一致性結果。
圖7. 理論計算
小結
透過結合弱作用性的銀催化劑與具有易分解性的烯基-N-鄰三氟甲基苯磺醯腙,避免了吡唑生成,作者成功解決了如何有效利用烯基-N-磺醯腙作為烯基卡賓前體的問題,發展了其與烯烴的高立體選擇性烯基環丙烷化方法學,反應具有條件溫和、底物範圍寬泛、高效高產率等優點,從而為具有高價值的烯基環丙烷類化合物的合成提供了強大方法。這一研究工作成功建立了即時生成烯基卡賓中間體的簡便方法,將推動烯基卡賓在有機合成中的應用研究。
研究成果發表在Chem Catalysis 上,東北師範大學青年教師劉兆洪和博士研究生楊勇為共同第一作者,通訊作者為畢錫和教授。該研究工作得到了國家自然科學基金的大力支援。
The merger of vinyl-N-triftosylhydrazones and silver catalysis to enable stereoselective vinylcyclopropanation of alkenes
Yong Yang, Zhaohong Liu, Qingmin Song, Paramasivam Sivaguru, Giuseppe Zanoni, Kuan Wang, Qiaowei Bi, Xihe Bi
Chem Catal., 2022, DOI: 10.1016/j.checat.2022.01.004
導師介紹
畢錫和
https://www.x-mol.com/university/faculty/9495