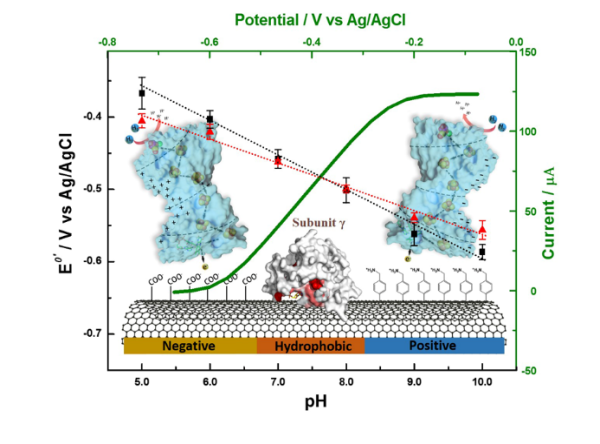
生物-電極在生物電池、生物感測和生物電合成等方面均有重要應用。在酶-電極構建過程中,為實現高效生物電子傳遞,需要設計一定的結合驅動力、合理的酶-電極互動方式和穩定的介面微環境。根據Marcus電子傳遞理論,傳遞距離和電勢差是制約傳遞速率的重要因素。由於酶分子複雜的表面理化性質和結構組成,探究酶-電極介面上酶與電極的結合方式和互作機制,使酶以特定空間取向固定於電極,對實現高效生物電子傳遞和提高酶-電極效能具有重要意義。
近日,中國科學院天津工業生物技術研究所體外合成生物學中心研究員朱之光帶領的團隊,以一種結構複雜的四亞基氫酶(PfSHI)為物件,透過設計不同的PfSHI-電極介面,結合直接電化學法對介面微環境的解析,驗證了酶與電極的互動結構域為γ亞基,其結合輔因子FAD和[2Fe-2S]2+/1+均能與電極進行直接電子傳遞。研究分析介面表面電荷、非轉化訊號、電子轉移數和酶構象之間的關係,預測了該氫酶在不同帶電電極表面上的微觀構象,建立了多個酶-電極介面模型。另外,該研究還測試PfSHI在不同pH值下直接電催化和間接電催化電流的大小及比率,對各模型相關動力學引數進行擬合和計算,得到不同酶-電極介面隧穿距離和電子傳遞效率的大小分佈,並設計出最優的一組酶-電極介面。基於以上結論及石英晶體微天平測試,研究預測了PfSHI在電極表面吸附動力學過程,闡明瞭PfSHI在功能化電極上的吸附機理,為構建高效能生物電催化介面奠定了理論基礎、提出了實驗模型。
相關研究成果發表在ACS Catalysis上。研究工作得到國家重點研發計劃、國家自然科學基金和天津市合成生物技術創新能力提升行動等的資助。
來源:中國科學院天津工業生物技術研究所