近日,復旦大學王文寧教授團隊與廣東省農業科學院農業生物基因研究中心、深勢科技團隊和上海蛋白質設施合作在英國皇家化學會(Royal Society of Chemistry, RSC)旗下期刊《Chemical Science》雜誌上發表文章“The Importance of the Compact Disordered State in the Fuzzy Interactions between Intrinsically Disordered Proteins”。該工作結合分子模擬和實驗研究從原子層面詳細解釋了固有無序蛋白(intrinsically disordered protein, IDP)的分子識別機制,為IDP的理性藥物設計提供可能性。
固有無序蛋白(Intrinsically disordered protein, IDP)是一類在天然狀態下缺乏穩定三維結構的蛋白質,在生物體內廣泛存在併發揮重要作用。理解IDP的相互作用機制,對於理解其生物學功能至關重要,也是基於IDP理性藥物設計的基礎。
本工作結合實驗研究和分子動力學模擬詳細地表徵了兩個蛋白(蛋白4.1G和NuMA)的固有無序區域之間相互作用的分子機制。185 μs的分子動力學(Molecular Dynamics, MD)模擬結合馬爾科夫態模型(Markov State Model,MSM)分析發現:在蛋白4.1G的無序結構域CTD的構象系綜中存在動力學中心態(Hub State),這些中心態更傾向於與配體蛋白NuMA結合,同時它們的結構特徵是配體結合的“熱點”位置有更規則的堆疊。核磁共振(NMR),單分子熒光共振能量轉移( smFRET)和熒光相關光譜(FCS)等實驗發現,4.1G-CTD的配體結合能力取決於蛋白整體的構象堆疊緊密程度,即緊湊的無序狀態(Compact Disordered State)有助於配體的識別。本工作進一步擴充套件了蛋白質研究中傳統的結構-功能正規化,加深了人們對固有無序蛋白相互作用機制的理解,併為IDP的理性藥物設計提供了重要理論基礎。
引言
蛋白質是生命活動的直接執行者, 其結構和動力學性質與生理功能密切相關。早期建立在大量晶體結構基礎上的蛋白質研究認為穩定的三維結構是蛋白質行使生物學功能所必需的,即"序列-結構-功能"的正規化:蛋白質的氨基酸序列決定三維結構,三維結構則決定其生物學功能。隨著結構生物學和生物物理化學的發展,人們發現大量蛋白質在行使功能時會發生構象變化,並存在多種不同的構象。這些研究表明蛋白質的動力學性質與其功能密切相關,推動蛋白質研究進入“結構-動力學-功能”時代。
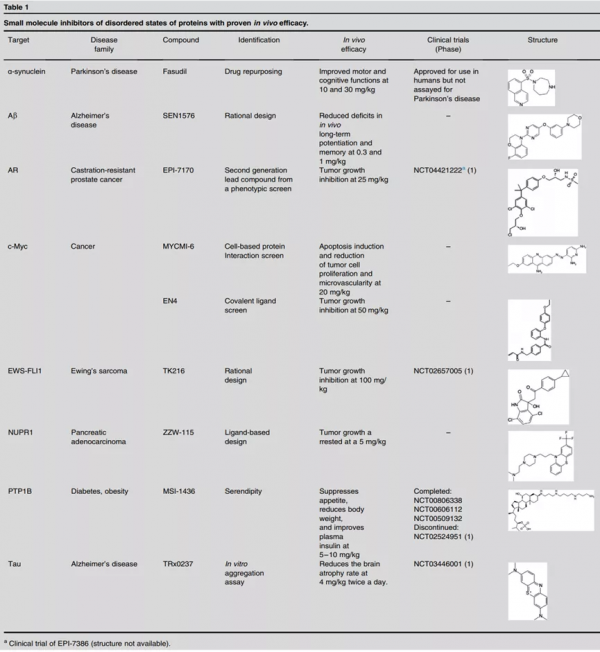
21世紀以來,人們開始注意到很多在天然狀態下沒有穩定三維結構的蛋白質或蛋白質區域依然發揮重要的生物學功能。在高等生物中,固有無序蛋白/固有無序蛋白區域的含量明顯高於低等生物。在人類基因組中,約40%的蛋白質含有長度大於 30 個氨基酸的無序區域。固有無序蛋白質(以下統稱為無序蛋白)與多種疾病密切相關,例如,79%的癌症相關蛋白含有長度大於30個氨基酸的無序片段。因此,無序蛋白質是一類重要的藥物靶標,相關研究為藥物研發提供了新的機遇。然而,由於大多數理性藥物設計策略都依賴於高解析度的蛋白質三維結構,無序蛋白所具有的動態特性給相關藥物設計造成了巨大的障礙。儘管如此,由於無序蛋白與包括神經性退行性疾病和癌症在內的多種疾病密切相關,研究者們一直致力於相應的藥物研發(表1)[1]。
IDP的作用機制
解析IDP的作用機制,對於理解其生物學功能至關重要,也為IDP理性藥物設計提供可能。IDP與具有穩定三維結構的蛋白質不同,在溶液中它的構象始終在快速變化,因此,IDP的潛在功能優勢是能夠以不同的構象與不同的配體結合。IDP的分子識別過程表現出極大的多樣性。一些IDP在結合配體後摺疊形成穩定的結構,即folding upon binding機制,例如:p53蛋白的無序結構域TAD在結合MDM2蛋白後形成穩定的螺旋結構(圖1)[2]。

圖1 p53蛋白的無序結構域transactivation domain(TAD)在結合MDM2蛋白後形成穩定的螺旋結構
然而,近年來一些IDP被發現能夠形成“模糊複合物”(Fuzzy Complexes),即IDP在結合配體形成複合物後仍然處於無序狀態,其中結合態的無序程度可能因配體或者細胞條件的不同而變化。大多數模糊複合物是由一個無序蛋白和一個結構蛋白質形成,而更極端的情況是兩者都是無序蛋白。2017年,復旦大學王文寧教授課題組報道了兩個無序蛋白區域之間可以形成極端模糊的相互作用:4.1G蛋白的C末端結構域(4.1G-CTD,aa 939-1005)和核有絲分裂相關蛋白 (NuMA) C末端區域的26個殘基(aa 1800-1825)形成多位點動態相互作用,並且在複合物中蛋白仍然保持無序狀態(圖2)[3]。2018年,Benjamin Schuler等人報道了兩個無序蛋白H1和ProTα之間形成的極端模糊複合物[4]。

圖2 4.1G和NuMA蛋白中的固有無序區域相互作用形成動態模糊複合物
雖然已有大量關於無序蛋白相互作用機制的研究,但是仍有許多問題需要探究。例如,無序蛋白識別過程中的主要的驅動力是什麼?無序蛋白是如何透過自身的構象變化來行使功能的,是否會有類似有結構蛋白中的一些狀態?哪種構象有利於結合以及結合親和力的決定因素是什麼?
固有無序蛋白的Compact Disordered State在分子識別中的重要性
IDP的動力學中心態(kinetic hub states)
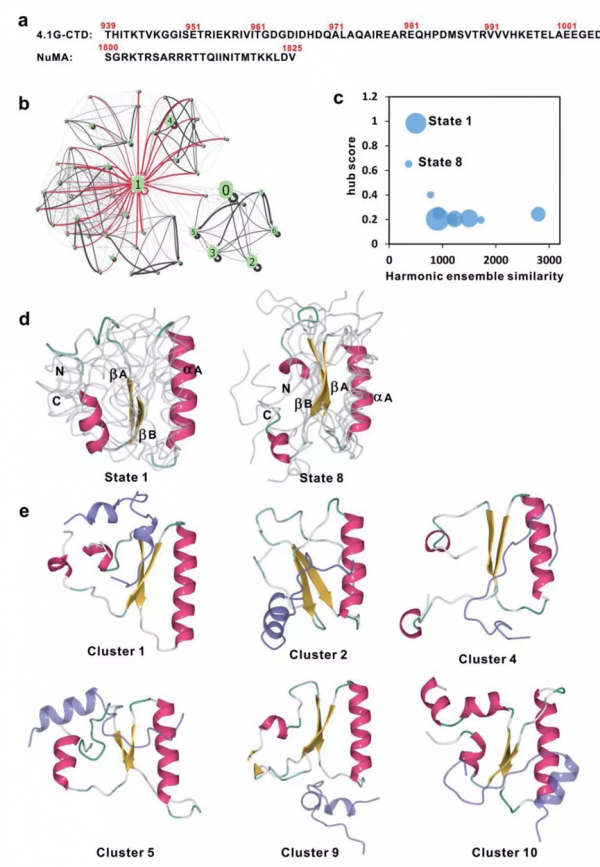
為了更加精細地分析無序蛋白結構域4.1G-CTD的構象系綜以及動力學性質,作者首先進行了185 μs的分子動力學模擬(Molecular Dynamics, MD),並且結合馬爾科夫態模型(Markov State Model)分析發現,在無序蛋白4.1G的構象系綜中存在動力學中心態(hub state)。中心態的特點是,動力學網路中很多其他狀態能夠直接、快速地轉換到中心態,而其他非中心態之間的轉換速率則慢很多。在以往的蛋白質摺疊研究中,人們發現穩定的摺疊態往往是動力學中心態。進一步分析發現,4.1-CTD的中心態更傾向於與其配體蛋白NuMA相結合,而中心態與其他構象狀態的明顯差別是有兩段比較穩定的β-摺疊片(βA和βB,圖3)。這兩個區域正好包含了與NuMA相互作用的主要位點,因此我們推測二級結構含量可能是中心態有利於配體結合的原因。
注:上圖:(a)4.1G-CTD和NuMA中參與結合的無序區域的氨基酸序列。(b)4.1G-CTD的動力學網路。(c)4.1G-CTD動力學網路中構象狀態的中心值(hub score)與其在4.1G-CTD/NuMA複合物構象系綜的相似度(Harmonic ensemble similarity)。(d)具有高中心值的態1和態8的代表性結構。(e)4.1G-CTD在複合物中的代表性結構。
pH變化誘導無序蛋白結構和動力學變化
為了驗證中心態在模糊複合物中的作用,我們嘗試尋找破壞兩個IDP結合的條件,並探究相應條件下4.1G-CTD的性質變化。經過多次嘗試後,我們發現在pH3.6的條件下會破壞4.1G-CTD與NuMA的相互作用。透過比較中性和酸性條件下的NMR化學位移,發現4.1G-CTD的βB區域的二級結構含量在酸性條件下降低,但是βA區域無明顯變化。因此,pH降低對配體結合的影響不能完全歸因於二級結構含量的變化。
於是,我們透過NMR自旋馳豫實驗研究pH對蛋白質主鏈動力學的影響。異核15N-1H NOE資料顯示酸性條件下4.1G-CTD所有殘基的NOE值相對於中性條件明顯降低(圖4a),表明蛋白質主鏈的運動加快。自旋弛豫時間比值T1/T2也在酸性條件下明顯降低,在無序蛋白中這說明主鏈的運動更加靈活(圖4b)。總體而言,自旋弛豫實驗結果表明,在酸性條件下,4.1G-CTD的主鏈動力學加速,這種變化很可能源於分子內相互作用減弱,蛋白的三維構象更加鬆散。
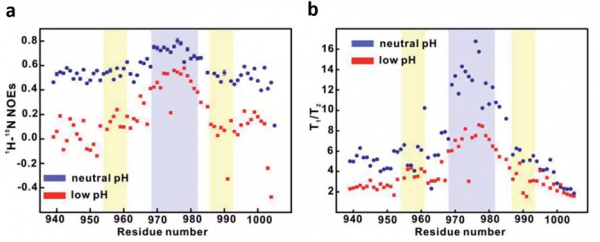
圖4 pH變化誘導無序蛋白動力學變化。兩種pH條件下4.1G-CTD的(a)異核15N-1H NOEs。(b)T1/T2的比較
為了驗證這一點,我們使用熒光相關光譜 (FCS) 測量了4.1G-CTD的流體動力學半徑 RH。結果顯示4.1G-CTD的流體力學半徑確實隨著pH值的降低而增大。我們進一步使用smFRET方法比較了4.1G-CTD在中性和酸性條件下標記位點之間的距離分佈。結果表明,降低pH後,標記位點間的距離增加(圖6)。因此,與我們的推測一致,4.1G-CTD的三維構象在酸性條件下變得更加鬆散。
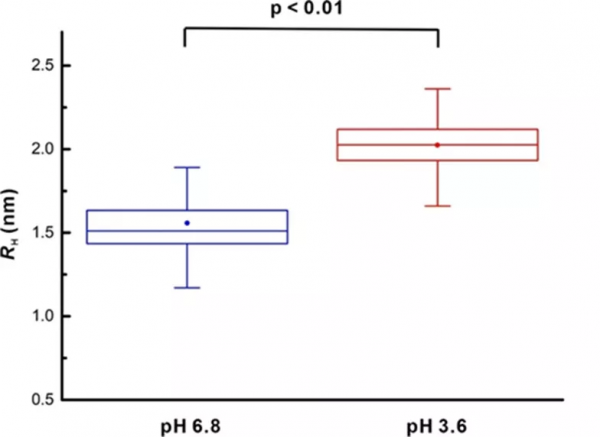
圖5 FCS測量的中性和酸性條件下4.1G-CTD的流體動力學半徑
分子動力學模擬揭示了更多的細節,在酸性條件下,4.1G-CTD結構鬆散的主要原因是分子內的長程靜電相互作用減少。且配體結合的兩個“熱點”區域(βA和βB)之間的接觸減少,最終影響其與NuMA的結合(圖7 a-c)。
注:上圖:(a)4.1G-CTD 殘基接觸機率的差值圖,顯示低pH下 4.1G-CTD 的殘基接觸機率減去中性pH下 4.1G-CTD 的殘基接觸機率;(b)顯示覆合物中 4.1G-CTD 的殘基接觸機率減去中性pH下 4.1G-CTD 的殘基接觸機率。紅色的表示結合NuMA 後接觸機率增強,藍色的表示減弱。(c)鹽橋數目的變化。(d)中心值與高阻搓接觸的比較。
這一工作揭示了IDP分子識別的新機制。儘管IDP缺乏穩定的三維結構,但蛋白的三維空間堆積,或一些結合“熱點”基序的空間排布仍然對配體識別非常重要。分子識別的特異性不僅源於兩個IDP上"熱點"基序的物理化學互補性,還取決於無序蛋白自身的構象狀態。IDP的這種緊湊的狀態可能與有結構蛋白具有相似的動力學屬性,例如MSM分析揭示4.1G-CTD具有中心態特徵,而具有穩定三維結構的蛋白中,其穩定摺疊態通常被認為是動力學網路的中心態(雖然並非總是如此)。至於中心態動力學特性與配體識別之間的必然聯絡是一個尚未解決的問題。有意思的是,這些中心態(MSM中的態1和8)具有更少的高阻挫接觸(Highly Frustrated Contacts)(圖7 d),這個性質也與蛋白質的穩定摺疊態類似。
展望
針對無序蛋白質的理性藥物設計是一個極其龐大的研究課題,傳統理性藥物設計策略大多依賴於高解析度的三維結構,對於IDP這類沒有穩定三維結構的蛋白來說,其熱力學和動力學中的重要狀態起到至關重要的作用。由於實驗技術在時間和空間解析度方面存在很多侷限,對於IDP的表徵基本上是一種構象平均,作為與實驗技術互補的方法,計算模擬在原子細節等方面具有獨特的優勢。當然其中很多方面還需要大家一起努力,例如IDP力場的發展,取樣效率的提高等等。
關於深勢科技
深勢科技成立於2018年,於2019年開啟規模化發展之路,致力於以新一代分子模擬技術解決微尺度工業設計難題。以打造切實服務於藥企、材料商和科研機構的模擬研發平臺為主要業務方向,以解放研發工作者的生產力為主要業務目標。
深勢科技具有強大的科研與產業落地能力。自研演算法深度勢能在保持量子力學精度準確性的基礎上,將分子動力學的計算速度提升了數個數量級;結合高效能計算,能夠對數十億原子規模的體系進行量子力學精度的計算模擬。團隊核心成員獲得2020年全球計算機高效能計算領域的最高獎項“戈登貝爾獎”,相關工作當選2020年中國十大科技進展和全球AI領域十大技術突破。