糖基磷脂醯肌醇(GPI)是一類由甘露糖、葡萄糖胺、磷酸乙醇胺和肌醇磷脂組成的複雜糖脂,可與一些蛋白質的羧基端共價相連,將其錨定在細胞質膜外小葉上發揮生物學功能。這類蛋白質被稱為糖基磷脂醯肌醇錨定蛋白(GPI-AP)。人體中,至少有150種蛋白質被鑑定為GPI錨定蛋白,廣泛分佈在各種型別的細胞中;這些GPI錨定蛋白參與較多生物學過程,如膜相關酶活性(PLAP、Phospholipase B、Aspartic proteinase等)、細胞訊號轉導(CD55、CD59和鈣通道調控亞基α2δ1等)、細胞粘附(OPCML、CD56等)和抗原呈遞(Thy-1、CD14、CD52等)等。GPI錨定蛋白生物合成過程的異常通常引發多種疾病,如陣發性夜間血紅蛋白尿、智力障礙和癲癇發作等。
GPI錨定蛋白的生物合成是一種廣泛存在於所有真核生物中的蛋白質翻譯後修飾型別,且參與該修飾過程的生化反應均是保守的,包括三個主要步驟:在內質網膜上合成GPI分子;在GPI轉醯胺酶(GPIT)的作用下,GPI-AP前體蛋白(ProGPI-AP)的羧基端(C端)訊號肽被切除與GPI分子共價相連,形成GPI-AP;GPI-AP經過進一步加工、成熟過程,透過高爾基體轉運至細胞膜上。GPI轉醯胺酶複合物是GPI錨定蛋白生物合成第二步的關鍵催化酶,由五個亞基組成,即PIGK、PIGU、PIGT、PIGS和GPAA1。目前,已報道了近30個與GPIT複合物相關的突變,這些突變會引發神經發育缺陷、先天性發育不良等疾病。多年以來,GPIT複合物發揮催化活性的結構基礎未得到揭示。
2月15日,中國科學院生物物理研究所趙巖課題組在Nature Structural & Molecular Biology上,發表了題為Structure of human glycosylphosphatidylinositol transamidase的論文,首次解析了人源糖基磷脂醯肌醇轉醯胺酶的3.1Å高解析度結構;同時,研究還透過改造綠色熒光蛋白GFP,利用CRISPR/Cas9基因編輯技術、流式細胞術及共聚焦顯微成像技術等,驗證了該酶的催化活性位點及發揮催化活性的重要氨基酸殘基。
GPI轉醯胺酶的整體結構形似一隻跳躍的海豚。在跨膜螺旋區,PIGU亞基分別與GPAA1、PIGK、PIGT、PIGS的跨膜螺旋相互作用,從而介導複合物的組裝;在內質網腔中,催化亞基PIGK的可溶結構域分別與其他亞基透過二硫鍵、靜電相互作用及範德華力相互作用,形成穩定的複合物結構並行使催化功能。運用CRISPR/Cas9基因編輯和共聚焦顯微成像等技術,研究構建了GPIT體內活性分析體系。結合突變實驗,研究證實了PIGK亞基中的第206位半胱氨酸C206、164位組氨酸H164以及58位天冬醯胺N58,形成了催化三聯體。H164可以透過吸引C206巰基基團中的質子,使後者親核攻擊蛋白質底物中的醯胺鍵,透過硫酯鍵形成GPIT與ProGPI-AP的中間體。GPI分子頭部的遊離氨基繼而透過親核攻擊中間體,取代形成GPI-AP。而N58則透過氫鍵作用穩定了H164的構象,從而保障催化反應高效的發生。此外,在催化三聯體下方的細胞膜內,PIGU、PIGT、PIGS、GPAA1亞基的跨膜螺旋構成了一個開放的空腔。研究在這個空腔中發現了一個形似GPI分子核心區的密度,提示該空腔可能是底物分子GPI的結合位點。
結構分析發現,GPIT複合物可與另外一個由6根跨膜螺旋組成的未知蛋白相互作用。質譜分析結果顯示,E3泛素連線酶RNF121在純化的GPIT複合物樣品中丰度較高,同時具有6根跨膜螺旋。RNF121的AlphaFold2預測結構較好地吻合三維電勢密度圖。進一步,體外pull-down實驗也證實了E3泛素連線酶RNF121與GPIT複合物有直接的相互作用。科研人員推測,E3泛素連線酶RNF121透過與GPIT複合物相互作用,從而監控GPIT複合物的組裝,對組裝不完全的或發生錯誤組裝的複合物進行修飾,從而使其進入降解途徑。
研究工作得到中科院戰略性先導科技專項(B類)、國家自然科學基金的支援。
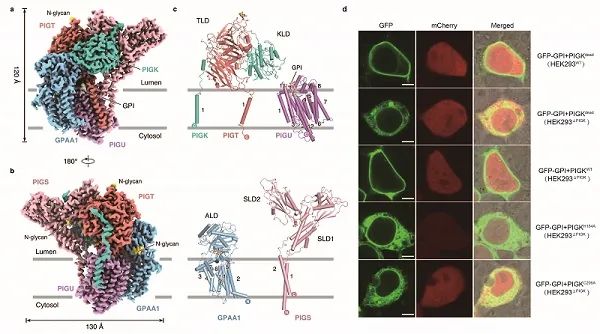
a-b、GPIT複合物的整體結構;c、GPIT複合物單個亞基的結構;d、利用共聚焦顯微成像技術驗證GPIT複合物的活性
來源:中國科學院生物物理研究所