編者按:美國時間1月20~22日,以線上會議召開的美國臨床腫瘤學會胃腸道腫瘤研討會(ASCO GI 2022)第二天,進行的是肝膽胰腫瘤領域研究進展及臨床經驗的交流。本期向您分享口頭報告專場的四篇研究進展。值得特別關注的是,中山大學附屬第一醫院彭振維教授為第一作者的一項研究入選口頭報告專場(ABSTRACT 380)。
【ABSTRACT 518】Trybeca-1:Eryaspase 聯合化療與單獨化療作為晚期胰腺癌患者二線治療的隨機Ⅲ期研究(NCT03665441)
Trybeca-1:A randomized, phase 3 study oferyaspasein combination with chemotherapy versus chemotherapy alone as second-line treatment in patients with advanced pancreatic adenocarcinoma(NCT03665441)
第一作者:Pascal Hammel, MD, PhD
背景:存在於紅細胞中的天冬醯胺酶eryaspase是一種正在開發的研究產品。體內的天冬醯胺酶誘導天冬醯胺和谷氨醯胺的降解,這對癌細胞的生長和存活至關重要。一項針對晚期胰腺癌患者的早期Ⅱb期研究顯示,eryaspase 聯合化療可提高總生存期(OS)和無進展生存期(PFS)。
方法:TRYbeCA-1 是一項隨機、開放標籤的Ⅲ期臨床研究,在該研究中,僅接受過一種全身性抗癌治療的晚期胰腺癌患者接受eryaspase 聯合化療。患者以1:1的比例隨機接受吉西他濱/白蛋白結合型紫杉醇或伊立替康/氟尿嘧啶(5FU)治療(取決於接受的一線治療),聯合或不聯合eryaspase,在第1天和第15天靜脈輸注給藥,每次4周為一週期。關鍵的入組標準包括一線全身治療時或之後的進展、ECOG 體能狀態0或1、Ⅲ~Ⅳ期疾病、疾病進展的記錄證據、可用的腫瘤組織和正常的器官功能。主要研究終點是OS。
雙側顯著性水平為5%、檢驗功效為90%的情況下,預設治療效果風險比為0.725時,計算後得知共需要412例患者。
結果:該研究共納入512例患者。治療組之間的基線特徵得到了很好的平衡。該研究未達到OS主要終點(HR:0.92: 95%置信區間[CI]:0.76~1.11;P值為0.375)。接受eryaspase加化療的患者的中位OS為7.5個月(95%CI:6.5~8.3),而單獨化療為6.7個月(95%CI:5.4~7.5)。與對照組109例患者相比,接受eryaspase和伊立替康-5FU治療的107例患者僅僅有OS獲益的趨勢,中位OS分別為8.0個月和5.7個月[HR 0.81(95%CI:0.60~1.09)]。根據各種預後因素進行分組,發現治療效果是一致的。eryaspase和對照組的中位PFS分別為3.7個月和3.5個月[HR:0.89(95%CI:0.73~1.07),P值為0.215]。eryaspase和對照組的疾病控制率分別為57.6%和49.0%(P值為0.047)。eryaspase組最常見的不良事件是虛弱、腹瀉和貧血(3~4級:分別為16.9%、7.66%和17.3%)。eryaspase似乎沒有明顯增加化療的毒性。
結論:這項大型前瞻性研究沒有達到改善eryaspase治療患者OS的主要終點。然而,在伊立替康/5FU亞組中eryaspase表現出良好的耐受性和令人鼓舞的生存獲益,值得進一步研究。(臨床試驗資訊:NCT03665441)
【ABSTRACT 378】Durvalumab聯吉西他濱加順鉑(GemCis)在治療晚期膽道癌的Ⅲ期、隨機、雙盲、安慰劑對照的臨床研究(TOPAZ-1)
A phase 3 randomized, double-blind, placebo-controlled study of durvalumab in combination with gemcitabine plus cisplatin(GemCis)in patients(pts)with advanced biliary tract cancer(BTC):TOPAZ-1
第一作者:Do-Youn Oh, MD, PhD
背景:膽道惡性腫瘤(BTC)是一種少見的異質性腫瘤,預後較差。BTC免疫學特徵研究表明,檢查點抑制劑可能產生抗腫瘤免疫反應,並且在單藥檢查點抑制劑在晚期腫瘤患者中能夠產生一定的臨床效果。一項Ⅱ期臨床研究表明,Durvalumab(PD-L1抑制劑)聯合吉西他濱加順鉑(GemCis)在晚期BTC中展現出令人鼓舞的抗腫瘤活性。TOPAZ-1研究(NCT03875235)是首個在晚期BTC中評估一線免疫療法加GemCis效果的III期全球臨床研究。
方法:在這項雙盲研究中,因不可切除區域性晚期、復發或轉移的不可切除BTC患者按1:1比例被隨機分為Durvalumab(1500 mg,q3w)聯合GemCis組(順鉑25 mg/m²+吉西他濱1000 mg/m²,d1、d8,q3w)和安慰劑聯合GemCis組(順鉑25 mg/m²+吉西他濱1000 mg/m²,d1、d8,q3w),最多治療8週期後,開始繼續使用Durvalumab(1500 mg,q4w)或安慰劑,直到出現疾病進展或毒性不可耐受。根據疾病狀態(最初不可切除、復發)和原發腫瘤位置(肝內膽管癌、肝外膽管癌、膽囊癌)進行隨機化分層。主要研究終點是總生存期(OS),次要終點包括無進展生存期(PFS)、客觀緩解率(ORR)和安全性。
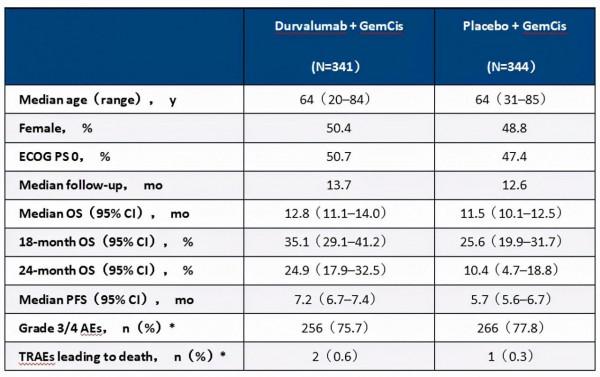
結果:在本次中期資料分析截止時間時(2021年8月11日),685例患者被隨機分配接受Durvalumab聯合GemCis(n=341)或安慰劑聯合GemCis(n=344;見表1)治療。該研究達到主要研究終點:Durvalumab聯合GemCis組較安慰劑聯合GemCis相比顯著改善OS(風險比[HR],0.80;95%置信區間[CI],0.66~0.97;P=0.021)。與安慰劑相比,durvalumab也顯著改善患者PFS(HR 0.75;95%CI:0.64~0.89;P=0.001)。Durvalumab組的ORR為26.7%,安慰劑組為18.7%。62.7%接受Durvalumab治療的患者和64.9%的接受安慰劑治療的患者發生3/4級治療相關不良事件(TRAE)。TRAE導致8.9%的接受Durvalumab的患者和11.4%的接受安慰劑的患者停用任何研究藥物。
結論:在晚期BTC患者中,Durvalumab+聯合GemCis與安慰劑聯合GemCis相比顯著改善OS和PFS,且安全性可控,這表明Durvalumab聯合GemCis有可能成為新的一線治療標準。臨床試驗資訊:NCT03875235。
*安全性資料百分比從安全性分析人群中計算得到(n=338 for durvalumab + GemCis and n=342 for placebo + GemCis)。
【ABSTRACT 379】Tremelimumab(T)和 durvalumab(D)作為不可切除肝細胞癌(uHCC)患者(pts)的一線治療的 3 期隨機、開放標籤、多中心研究:HIMALAYA。
Phase 3 randomized, open-label, multicenter study of tremelimumab(T)and durvalumab(D)as first-line therapy in patients(pts)with unresectable hepatocellular carcinoma(uHCC):HIMALAYA
第一作者:Ghassan K. Abou-Alfa, MD, MBA
背景:一項Ⅱ期不可手術切除肝細胞癌臨床研究(Study 22,NCT02519348)表明,在STRIDE(單次給藥tremelimumab+常規間隔給藥度伐利尤單抗)方案(以前稱為T300+D)中,在D藥(度伐利尤單抗,抗PD-L1抗體)中新增單次T藥(Tremelimumab,抗CTLA-4抗體)初始劑量,顯示出令人鼓舞的臨床效果和可耐受的毒性,這意味著單次T藥的暴露足以改善D藥的活性。HIMALAYA(NCT03298451)研究評估STRIDE或D與索拉非尼(S)在不可手術切除肝癌中的有效性和安全性。
方法:HIMALAYA研究是一項開放標籤、多中心、Ⅲ期臨床研究,其中不可切除且既往未接受過全身治療的患者最初被隨機分配至STRIDE組(T 300 mg加D 1500 mg[一劑]加D 1500 mg每4周[Q4W])、D組(1500 mg Q4W)、S組(400 mg每日兩次)或T 75 mg Q4W(4劑)加D 1500 mg Q4W(T 75+D)。對Study 22進行計劃分析顯示T 75+D與D沒有顯著差異後,故停止招募T 75+D。主要研究目標是比較STRIDE方案與S方案的總生存期(OS)。次要研究目標是D與S在OS方面的非劣效性(NI)(NI臨界值:1.08)。次要研究終點包括無進展生存期(PFS)、客觀緩解率(ORR;RECIST v.1.1)、緩解持續時間(DoR)和安全性。
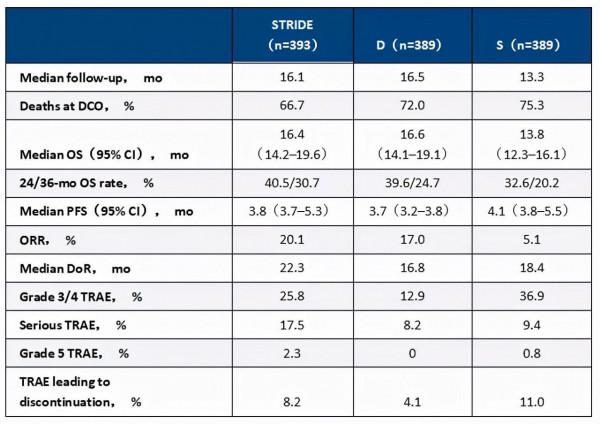
結果:共計有1171例患者被隨機分配到STRIDE組(N=393)、D組(N=389)或S組(N=389)組。在資料分析截止(DCO)時,該研究達到主要研究目標:STRIDE組較S組的OS顯著改善(風險比[HR],0.78;96%CI:0.65~0.92;P=0.0035;見表2)。D在OS方面較S達到了非劣效目標(HR 0.86;96%CI:0.73~1.03)。STRIDE(20.1%)和D(17.0%)的ORR高於S組(5.1%)。沒有發現新的安全特徵。3/4級治療相關不良事件(TRAE)在不同分組中的發生率分別為25.8%(STRIDE)、12.9%(D)和36.9%(S)。3/4級肝臟TRAE在不同治療組的發生率分別為5.9%(STRIDE)、5.2%(D)和4.5%(S)的患者中。未發生食管靜脈曲張出血的TRAE。不同組導致停藥的TRAE發生率分別為8.2%(STRIDE)、4.1%(D)和11.0%(S)。
結論:HIMALAYA是首個在多樣化、具有代表性的不可切除HCC人群中進行深入的長期隨訪,以評估單一和聯合免疫治療的效果的大型Ⅲ期臨床試驗。度伐利尤單抗在安全性方面不劣於索拉非尼。與索拉非尼相比,STRIDE方案中單次起始劑量tremelimumab聯合度伐利尤單抗的組合顯示出卓越的療效和有利的收益-風險特徵。STRIDE方案為晚期不可切除肝癌提供一種新的一線系統治療方案。臨床試驗資料:NCT03298451。
【ABSTRACT 380】侖伐替尼聯合經動脈化療栓塞作為晚期肝細胞癌的一線治療:一項Ⅲ期、多中心、隨機對照試驗
Lenvatinib combined with transarterial chemoembolization as first-line treatment of advanced hepatocellular carcinoma:A phase 3, multicenter, randomized controlled trial
第一作者:彭振維 中山大學附屬第一醫院
背景:LAUNCH研究是一項多中心、隨機、開放標籤、平行分組Ⅲ期臨床試驗,旨在比較侖伐替尼聯合TACE與侖伐替尼單獨作為一線治療在晚期肝細胞癌(HCC)患者中的有效性和安全性。
方法:晚期HCC患者以1:1的比例隨機分配接受侖伐替尼聯合TACE(LEN-TACE組)和樂伐替尼(LEN組)。隨機分層因素包括:東部腫瘤協作組體能狀態評分(0 vs. 1)、癌栓(存在vs. 不存在)、體重(<60 vs. ≥60kg)和腫瘤位置。在LEN組和LEN-TACE組中,患者在隨機化後3天內均接受口服lenvatinib治療。對於體重≥60 kg的患者,初始劑量為12 mg/d;對於體重<60 kg的患者,初始劑量為8 mg/d。LEN-TACE組在初次侖伐替尼使用後1天開始進行TACE治療,然後根據腫瘤和肝功能情況決定是否繼續進行TACE治療。該研究的主要終點是總生存期(OS)。次要終點是無進展生存期(PFS)、客觀緩解率(ORR,根據mRECIST完全緩解或部分緩解的患者比例)和不良事件。資料中期分析的截止日期為2021年9月20日。
結果:總體而言,來自中國12家醫院的338例患者被隨機分配接受侖伐替尼聯合TACE(n=170)或侖伐替尼(n=168)治療。LEN-TACE組的中位隨訪時間為18.4個月(95%CI:13.7~23.1個月),LEN組為17.0個月(95%CI:14.2~19.8個月)。LEN-TACE組的中位OS為17.8個月(95%CI:16.1~19.5),LEN組為11.5個月(95%CI:10.3~12.7)(分層後的死亡風險比[HR]=0.45,95%CI:0.33~0.61,P<0.001)。LEN-TACE組的中位PFS顯著長於LEN組(10.6個月 vs. 6.4個月,HR[風險比]=0.43,P<0.001)(圖1)。與單獨使用侖伐替尼相比,侖伐替尼聯合TACE顯著改善ORR(54.1%對25.0%,P<0.001)。LEN-TACE組的3-4級不良事件發生率較LEN組更高:ALT升高(30[17.6%] vs. 2 [1.2%],P<0.001),AST升高(39[22.9%]] vs. 3[1.8%],P<0.001),高膽紅素血癥(16[9.4%] vs. 5[3.0%],P=0.014)。
結論:綜上所述,本研究表明侖伐替尼聯合TACE可改善臨床預後,可能成為晚期肝細胞癌的新一線治療方案。臨床試驗資訊:NCT03905967。